
题目列表(包括答案和解析)
12、为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是
|
|
物质 |
试剂 |
分离方法 |
|
① |
硝酸钾(氯化钠) |
蒸馏水 |
降温结晶 |
|
② |
二氧化碳(氯化氢) |
饱和碳酸钠溶液 |
洗气 |
|
③ |
乙醇(水) |
生石灰 |
蒸馏 |
|
④ |
苯(苯酚) |
浓溴水 |
分液 |
A.①② B.只有③ C.①③ D.③④
11、某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.溶液中不可能存在:c(Na+)>c (A-)>c(OH-)>c(H+)
B.若溶液中c(A-)== c(Na+),则溶液一定呈中性
C.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
D.若溶质为NaA、HA,则一定存在: c(A-)>c(Na+)>c(H+)>c(OH-)
10、下列叙述中正确的是
A.0.1 mol Cu和足量的稀硝酸反应时,转移的电子数为0.1×6.02×1023
B.4.4g CO2中所含有的原子总数为0.3×6.02×1023
C.标准状况下,2.24L溴乙烷中含有的溴离子数目为0.1×6.02×1023
D.在1L 0.1mol/L的硫酸铁溶液中含有的三价铁离子数为0.2×6.02×1023
9、下列反应的离子方程式正确的是
A.氟气通入水中:2F2+2H2O=4F-+4H++O2
B.向小苏打溶液中加入过量的石灰水: Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C.硫氢化钠溶液与碘反应:HS-+I2=S↓+2I-+H+
D.FeBr2溶液与足量Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
8、下列叙述正确的是
①硫酸钡难溶于水和酸,可做X光透视肠胃的药剂
②蛋白质遇酒精会变性,医疗中用75%的乙醇溶液进行消毒
③棉花、蚕丝、人造羊毛的主要成分都是纤维素
④加酶洗衣粉是在洗衣粉中加入能使蛋白质水解的碱性蛋白酶,为了提高它的活性,洗衣服时温度越高效果越好
⑤碳酸钠、氢氧化钠、碳酸钙、碳酸氢钠等都可以中和酸,故都可以作为治疗胃酸过多的药物
⑥明矾净水利用了胶体的性质
⑦氢氟酸储存在玻璃瓶中
⑧可以用二氧化硅和水反应制备硅酸胶体
A.①②③⑦ B.①②⑥ C.①③④⑧ D.全都正确
7、联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,很多人称这次大会为“人类拯救地球的最后机会”。据报道,在火星和金星大气层中发现了一种非常特殊的会导致温室效应的气态化合物,它的结构式为:16O=C=18O。下列说法正确的是
A.16O与18O为同种核素
B.16O=C=18O与16O=C=16O互为同位素
C.16O=C=18O的化学性质与16O=C=16O完全不同
D.目前提出的“零碳经济”,目标是不再向环境排放CO2,有利于控制温室效应
21.某水质稳定剂是由马来酸酐和乙酸乙烯酯聚合而成,可有效防止水垢的产生。
(1) 马来酸酐可由马来酸分子内脱水制得。
马来酸酐分子中含有五个原子构成的环状结构;马来酸的相对分子质量为116,实验式为CHO,其核磁共振氢谱显示有两个波峰,面积比为1 : 1。
① 马来酸的分子式为 。
② 马来酸能发生的反应是 (填写序号)。
a. 加成反应 b. 氧化反应 c. 消去反应
d. 酯化反应 e. 水解反应 f. 加聚反应
③ 马来酸酐结构简式为 。
(2)已知:Ⅰ. 在一定条件下,乙炔能分别与水、乙酸发生加成反应。
Ⅱ. 乙烯醇(CH2=CHOH)不能稳定存在,迅速转变成乙醛。
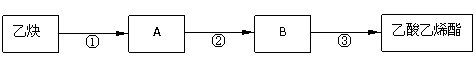 只用乙炔为有机原料合成乙酸乙烯酯(CH3COOCH=CH2),合成路线如下:
只用乙炔为有机原料合成乙酸乙烯酯(CH3COOCH=CH2),合成路线如下:
写出反应②、③的化学方程式:
②
③
(3)乙酸乙烯酯有多种同分异构体。与乙酸乙烯酯具有相同官能团且能发生银镜反应的同分异构体有 种,写出其中一种同分异构体的结构简式:
。
(4)写出用马来酸酐与醋酸乙烯酯发生加成聚合反应合成水质稳定剂的化学方程式:
。
北京市宣武区2009-2010学年度第一学期末质量检测
20.(10分)由C、Cu、FeCO3、铜锈[主要成分为Cu2(OH)2CO3]组成的固体混合物,进行了如下所示的实验过程:

回答下列问题:
(1)无色气体1的成分是: 。
(2)混合物乙中加入NaNO3后,反应的离子方程式是:
。
(3)溶液X中含有的金属阳离子是 。
(4)无色气体3的成分是: ;检验无色气体3成分的实验方案是:
。
19.(10分)化合物A由两种不同短周期元素X、Y组成,具有良好电绝缘性。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为
。
(2)0.1 mol/L X的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离子
方程式为
(3)Y的单质在放电条件下能与氧气反应。写出化学方程式:
。
(4)化合物A能与水缓慢反应生成含Y的化合物Z,Z分子中含有10个电子。写出该
反应的化学方程式: 。
(5)工业用X的单质和化合物Z在高于1700K反应制备A。已知该反应可以认为是置
换反应,该反应的化学方程式是 。
18.(10分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g) ΔH2
CH3OH(g) +
H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
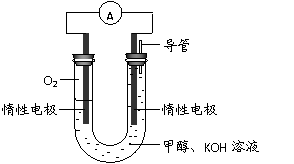 (3)某实验小组依据甲醇燃烧的反应原理,
(3)某实验小组依据甲醇燃烧的反应原理,
设计如右图所示的电池装置。
① 该电池正极的电极反应为
。
② 工作一段时间后,测得溶液的
pH减小,该电池总反应的化学方程式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com