
题目列表(包括答案和解析)
1. 2009年11月25日,我国提出控制温室气体排放的措施和近期指标,旨在 “善待地球--科学发展”。下列不符合这一主题的是
A.发展循环经济,构建资源节约型社会
B.加高工厂的烟囱,使烟尘和废气远离地表,减少污染
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D.采用“绿色化学”工艺,建立环境友好型化工体系
30.(9分)某化学实验小组,通过Li3N固体水解生成氢氧化锂和氨气的反应制氨气,并进行氨气还原氧化铜的实验探究。如下图所示,给出了本实验可供选择的装置:

 北京市房山区2010届上学期期末统测
北京市房山区2010届上学期期末统测
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。观察到的现象,
假设:①.有明显现象;②.无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是______。
(5)基于假设②,结论是____,请设计实验进一步验证该结论,叙述实验操作:___。
29.(12分)目前在水的净化处理、纸浆的加工等化学工艺中普遍用到一种高分子化合物聚丙烯酰胺。它可由化合物A(分子式C3H6)经以下反应流程制得:

已知:(1)3RCOOH+PCl3 3RCOCl+H3PO3
3RCOCl+H3PO3
(2)RCOCl+NH3 RCONH2+HCl
RCONH2+HCl
试回答下列问题:
(1)写出A和H的结构简式A ,H 。
(2)关于丙烯酰胺的下列叙述中正确的是: 。
A.能使酸性KMnO4溶液褪色; B.能发生加聚反应生成高分子化合物;
C.与α-氨基乙酸互为同系物; D.能与H2发生加成反应
(3)写出D E的反应方程式:
。
E的反应方程式:
。
(4)C D的目的是
。
D的目的是
。
(5)上述反应过程中属于取代反应的是: 。
(6)丙烯酰胺有多种同分异构体,同时符合下列要求的同分异构体有多种:
①链状,无碳碳叁键; ②同一个碳原子上不能连有2个双键。
试写出其中的2种的结构简式: 、 。
(1)该消毒液的酸碱性:________,原因是(用离子方程式表示)________。
(2)该消毒液可能具有的化学性质是_________性和________性(任意写出两种)。
(3)推测造成该消毒液失效的外界因素可能有____ 或 (任意写出两种),写出其中一种因素引起该消毒液失效涉及的化学反应方程式____。
33、(16分)海水是巨大的资源宝库,在海水淡化及综合利用方面,广东位居全国前列。从海水中提取食盐和溴的过程如下:
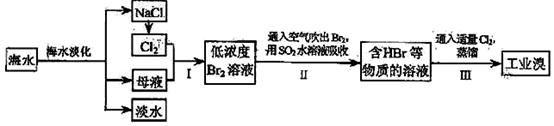
(1)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,
(4)某化学研究性学习小组为 了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:

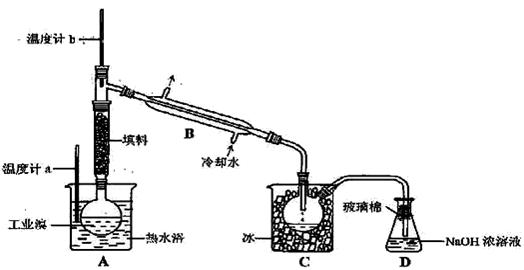
请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
32、(18分)现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
⑴已知:1 mol N2(g)与适量H2(g)完全反应,生成NH3(g),放出92.2 kJ热量,写出反应的热化学方程式:
。
⑵若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2
(填“>” “=” 或 “<” )。
 ⑶在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为
,用氮气表示的反应速率为:
。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
⑶在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为
,用氮气表示的反应速率为:
。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
(任意写一条)。
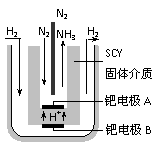 (4)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在
(4)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在
常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高
质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶
薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。
请回答:在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。
钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
31、 (18分)目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方。“达菲”的主要合成原料是我国盛产的莽草酸。从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒。下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构)。
(18分)目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方。“达菲”的主要合成原料是我国盛产的莽草酸。从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒。下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构)。
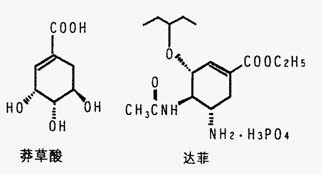
(1)“达菲”的相对分子质量为410.4,扣除H3PO4后的部分称为“自由基奥司他韦”。试求“自由基奥司他韦”的相对分子质量___________;“自由基奥司他韦”能与磷酸结合,说明氨基具有______________性。
(2)比较莽草酸与“达菲”的结构,推测“达菲”分子中-COOC2H5基团可能是由莽草酸的_______________基,通过_________________反应(填写反应类型)制得。
(3)莽草酸中含有的官能团有________________________________(写名称).
(4)下列有关莽草酸的说法中正确的是______________________________________。
①分子式为C7H10O5 ②不溶于水 ③能使FeCl3溶液显紫色 ④能使溴的四氯化碳溶液褪色 ⑤lmol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为4:l。
(5)莽草酸与C2H5OH发生酯化反应的化学方程式(有机物用结构简式表示)是______________________________________________________。
(6)莽草酸在浓硫酸作用下加热可得到B(C7H6O3),B的同分异构体中既含有酚羟基又含有酯基的共有______ ______种,写出其中一种同分异构体的结构简式 。
30、(12分)短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物,它们之间有图示的转化关系,已知C为密度最小的气体,甲俗称刚玉,是红宝石的主要成分。
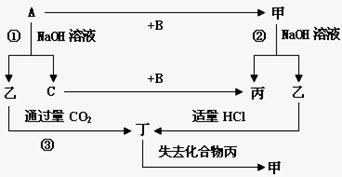
⑴写出丙的名称: 。
⑵组成单质A的元素在周期表中的位置是 。
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式 。
②乙溶液与过量CO2反应的离子方程式 。
(4)A与Fe2O3的反应类型为 。
23、关于下列图示的说法中正确的是

A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH<0
CO2(g)+H2(g)”中的ΔH<0
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1︰1
C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
22、 某些含羟基的药物具有苦味,如右图结构的氯霉素:此药物分子中碳链末端羟基
某些含羟基的药物具有苦味,如右图结构的氯霉素:此药物分子中碳链末端羟基
(-OH)中的氢原子换成来自棕榈酸中的原子团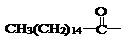 后,苦味消失,成为便于口服的无味氯霉素。以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素。以下关于无味氯霉素的叙述中正确的是( )
A.它是棕榈酸的盐类 B.它是棕榈酸的酯类
C.它的水溶性变差,所以苦味消失 D.它的水溶性变良,所以苦味消失
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com