
题目列表(包括答案和解析)
6.下列说法中正确的是
A.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
B.1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
C.热化学方程式中的化学计量数只表示物质的量,可以是分数
D.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
5.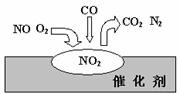 在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图,下列说法错误的是
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图,下列说法错误的是
A.NO2是该过程的中间产物
B.催化过程中催化剂没有参与化学反应
C.汽车尾气的主要污染成分包括CO和NO
D.催化转化总反应为:2NO+O2+4CO  4CO2+N2
4CO2+N2
4.下列各组离子在溶液中能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶
A.Al3+、Na+、SO42-、NO3-
B.Ca2+、Mg2+、HCO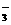 、NO
、NO
C.Na+、Fe2+、AlO2-、Br- D.K+、Na+、SiO32-、ClO-
3.光纤通信是一种现代化的通信手段,它可以提供大容量、高速度、高质量的通信服务。目前,我国正在大力建设高质量的宽带光纤通信网络,即信息高速公路。光纤通信所使用的光缆,其主要部件为光导纤维。下列说法正确的是
①制造光导纤维的主要原料是CaCO3;②制造光导纤维的主要原料是SiO2;③光导纤维传递光信号的基本物理原理是光的全反射;④光导纤维是一种半导体。
A.①④ B.②③ C.①③ D.②④
2.下列叙述中不正确的是:
A.过滤时,漏斗下端要紧贴接液烧杯内壁
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
D.蒸发结晶时应将溶液蒸干,然后停止加热
1.化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A.含氮、磷化合物的生活污水大量排放会使水体富营养化
B.甲型H1N1流感可防、可控、不可怕,在教室里可喷洒84消毒液杀死该病毒
C.氯气是合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料
D.“低碳经济”就是要提倡大量使用煤、石油、天然气等化石燃料
20、(12分,每空2分)小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.504g NaHCO3,1片小苏打片和胃酸完全中和,被中和的氢离子
是 mol;
(2)若胃舒平每片含0.234gAl(OH)3。中和胃酸时,3片小苏打相当于胃舒平 片;
(3)达喜的化学成分是镁和铝的碱式碳酸盐。
①取一定质量的该碱式盐,逐滴加入2.0mol/L盐酸使其溶解,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时正好反应完全,则该碱式盐样品中OH-与 CO32-的物质的量之比为 ;
②在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后 重1.74g,则Mg2+与Al3+的物质的量之比为 ;
③由以上结论可推知该碱式盐的化学式为 ;试写出该碱式盐与盐酸完全反应的化学方程式 。
19. (16分,每空2分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含_________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 ________所致。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)应用与拓展:
①在100mL2 mol·L-1FeBr2溶液中通入4.48LCl2(标准状况),溶液呈黄色所发生的离子方程式为 。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
18、(18分,每空2分)中学化学中常见的物质有如下图所示的转化关系(反应条件略去)。X、Y、Z、W是单质,其余均为化合物,A、W、Z常温下呈气态,且A是一种大气污染物,B是一种常用的酸。
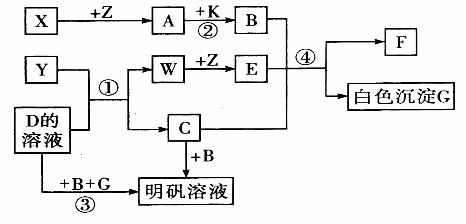
(1)写出下列物质的化学式:
Y 、A 、C ;
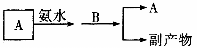 (2)D的电子式为
;
(2)D的电子式为
;
(3)我国生产B的工业中,常采用以下方式处理尾气A:
试从综合经济效益的角度分析,这样处理的目的是(答出其中两点即可)
a. ;b. ;
(4)反应①的化学方程式 ;
反应②的化学方程式 ;
反应④的离子方程式 。
17.(14分,每空2分)下表由元素周期表的前三周期去掉副族上方空区域后组合而成。请用相应的化学用语回答下列问题。
|
a |
|
|
|||||
|
b |
|
|
c |
d |
e |
f |
|
|
g |
|
h |
|
|
i |
|
|
(1)请写出满足以下要求的2个置换反应的化学方程式。
①所涉及的元素均为a-i中的元素;
② 4种单质分属于4个不同 的主族。
; 。
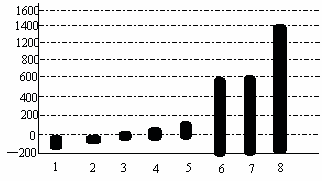
(2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图如下(已知柱形1代表Ar),则其中序列“2”表示的单质为 (填化学式)。
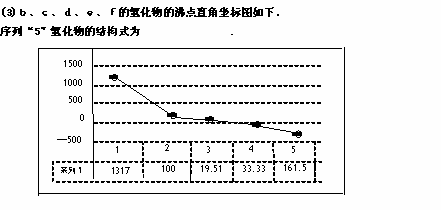
(4)单质a单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质e在该燃料电池
的 极发生电极反应,电极反应式为 。
(5)在e单质中燃料4克i单质生成一种有刺激性气味的气体,同时放出aKJ热量,写出该反应的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com