
题目列表(包括答案和解析)
4. 能实现下列物质间直接转化的元素是 ( )
能实现下列物质间直接转化的元素是 ( )
A.硅 B.硫 C.铜 D.铁
3.25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断正确的是( )
A.前者仅存在水解平衡,不存在电离平衡
B.两溶液中存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)前者增大后者减小
2.用浓氯化铵、磷酸铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高
②幕布的质量增加
③氯化铵、磷酸铵分解吸收热量,降低了温度
④氯化铵、磷酸铵分解产生的气体隔绝了空气
A.①② B.③④ C.③④ D.②④
1.“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫:这与高中化学中“焰色反应” 知识相关。下列说法中正确的是 ( )
A.非金属单质燃烧时火焰均为无色
B.只有金属单质灼烧时火焰才有颜色
C.用Pt做钾的焰色反应时不需要透过蓝色钴玻璃观察
D.NaCl与Na2CO3灼烧时火焰颜色均为黄色
22.(8分)某学校课外兴趣小组为了研究家用含少量硫元素的煤的燃烧效率(已知煤的燃烧效率=完全燃烧的碳的质量÷碳的总质量),他们用W g煤在实验室中的密闭体系中燃烧,将燃烧后的气体分成两等份,甲、乙两组再分别进行下列实验:
甲:把其中的一份气体依次通过①足量高锰酸钾溶液②品红稀溶液③足量的澄清石灰水,然后过滤、洗涤、干燥,称得固体的质量为a g;
乙:把另一份气体依次通过①足量的碱石灰②m g足量的灼热CuO,充分反应后称量②的固体质量为b g。
根据上述实验回答下列问题:
⑴甲能否得出燃烧效率: (填“能”或“否”),
甲实验中步骤①的目的是 ,步骤②的目的是 。
⑵根据甲、乙的数据,该煤的燃烧效率为 ,该煤中碳的含量为 (用含w、m、a、b的表达式表示,不必化简)。
21.(12分)
二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
① 将干燥的氯气在110℃ - 140℃与硫反应,即可得S2C12粗品。
② 有关物质的部分性质如下表:
|
物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
|
S |
112.8 |
444.6 |
略 |
|
S2C12 |
-77 |
137 |
遇H2O生成HCl、SO2、S; 300℃以上完全分解; S2C12 + C12  2SCl2 2SCl2 |
设计实验装置图如下:
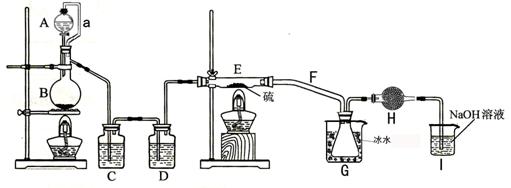
请回答下列问题:
①如何检查装置的气密性_________________________________________;
②装置中导管a的作用是_____ ____________;
③C、D中的试剂分别是_______________________、____________________;
④F导气管管径要大一些是为了防止____________________;
⑤S2C12粗品中可能混有的杂质是(填写两种化学式)______________、________________;
⑥如果没有H装置产率会大大降低,原因是___________ ;(用化学方程式表示)
⑦I中NaOH的作用是________________________。
20.(8分)A、B、C、D、E是中学常见的五种物质,其转化关系如图所示。反应I、II均在水溶液中进行,其中某些物质可能已略去。已知D是双原子分子形成的单质,C、E是化合物。

(1)若A是气态单质,其水溶液具有漂白性,D在常温下为固态。E是一种可溶性强碱,其焰色反应为黄色。则
①A、C的化学键类型分别为 , ;
②写出C的一种用途 ;
③A与B在E溶液中还可以发生另外一个反应,每1 mol B完全反应转移6 mol 电子,写出该反应的化学方程式 。
(2)若A是金属单质,D是无色气体,E是A的盐溶液。则
①D的化学式是
②C溶液与酸性高锰酸钾溶液发生反应的离子方程式为 。
19.(12分) 有A、B、C、D、E、F、G六种短周期元素,原子序数依次增大。
|
B |
C |
D |
|
|
G |
A元素的单质在自然界中最轻,B、C、D、G在周期表的位置如图,
它们的原子序数之和为37。E元素的电负性在同周期中最小,F
是同周期中原子半径最小的金属元素。试回答:
(1)A2D、A2G沸点较高的是__ (填化学式),原因是 ;
(2)E位于元素周期表第_____周期第________族,F原子结构示意简图为: ,G的基态原子核外电子排布式是 ;
(3)将0.1mol·L-1 G的最高价氧化物的水化物溶液逐滴滴入由B、D、E三种元素组成的无机盐溶液中,则刚开始时发生反应的离子方程式为 ;
(4)C与A形成10电子化合物的电子式是 ,该化合物与D2在一定条件发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为 ;
(5)已知16g单质G完全燃烧放出148kJ热量。写出单质燃烧的热化学方程式
18.(6分)有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3- ,取该溶液进行实验:
|
实验步骤 |
实验现象 |
|
(1)取少量该溶液,加几滴紫色石蕊试液 |
溶液先变红 |
|
(2)取少量该溶液加热浓缩,加Cu片和浓 H2SO4 ,加热 |
有无色气体产生,气体遇空气变成红棕色 |
|
(3)取少量该溶液,加BaCl2溶液 |
有白色沉淀 |
|
(4)取(3)中上层清液,加AgNO3溶液 |
有白色沉淀,且不溶于稀HNO3 |
|
(5)取少量该溶液,加NaOH溶液 |
有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有 ,溶液中肯定存在的离子是 。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)
17.(6分)已知某反应A(g)+B(g)  C(g) +D(g) 过程中的能量变化如图所示,回答下列问题。
C(g) +D(g) 过程中的能量变化如图所示,回答下列问题。
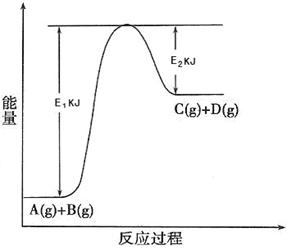
(1)该反应是_________反应(填“吸热”、“放热”),该反应的△H= KJ·mol-1(用含E1、E2的代数式表示),1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量 (填“一定高”、“一定低”、“高低不一定”)。
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1_________,E2________,△H (填“增大”、“减小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com