
题目列表(包括答案和解析)
1.下列说法正确的是 ( )
A.H与D、16O与18O互为同位素;H216O、D218O、T2O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在1个C2H5OH分子中,含有9个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由IA族和ⅥA族元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子型化合物
24.某学生用 和
和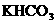 组成的某化合物进行试验,测得如下数据(盐酸的物质的量浓度相等):
组成的某化合物进行试验,测得如下数据(盐酸的物质的量浓度相等):
|
实验编号 |
① |
② |
③ |
|
盐酸体积 |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物) |
9.2g |
16.56 g |
27.6 g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
根据表中数据试计算:
(1)盐酸的物质的量浓度。
(2)混合物中NaHCO3的质量分数。
22.(12分)三草酸合铁酸钾晶体 ·
·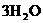 可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸(A)、1.0 mol·L-1HNO3(B)、1.0 mol·L-1盐酸(C)、1.0 mol·L-1 NaOH(D)、3%H2O2(E)、0.1mol·L-1KI(F)、0.1 mol·L-1CuSO4(G)、20%KSCN(H)、澄清石灰水(I)、氧化铜(J)、蒸馏水(K)、澄清石灰水(L)。
(1)要验证产物中有CO2、CO存在的试剂________应选(按先后顺序把所选试剂的代号字母填人空格内。)
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有 。验证固体产物中
。验证固体产物中 的方法是
。
的方法是
。
(3)固体产物中铁元素存在形式的探究。
固体产物中铁元素存在形式的探究。
①提出合理假设;假设1:只有Fe;
假设2:只有FeO;
假设3:FeO和Fe。
②设计实验方案证明假设
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振汤便碳酸钾完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。
步骤2:将步骤1中的不溶固体产物加入1.0mol·L-1盐酸中。
步骤3:将步骤1中的不溶固体产物加入足量的0.1 mol·L-1CuSO4中充分反应后过滤、洗涤后,将沉淀物溶于1.0 mol·L-1盐酸,再加入20%KSCN,最后加入3%H2O2。
③实验过程(填写下表的空格)
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体 |
固体产物部分溶解 |
|
步骤2:向试管中加入适量硫酸铜溶液,再加入少量将步骤1中的不溶固体,充分振荡 |
(1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设 成立。 (2)若蓝色溶液颜色明显改变,且有暗红色固体生成.则证明有 存在。 |
|
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN |
结合步骤2中的(2): (1)若溶液基本无色,则假设(1)成立 (2)若 ,则假设 成立 |
21.(10分)通常状况下,X、Y和Z是由两种短周期元素形成的三种气态单质,X的水溶液呈淡黄绿色,反应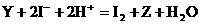 常作为Y的鉴定反应。
常作为Y的鉴定反应。
(1)X与Z的相互关系是: 。
(2)二氧化硫通入x的溶液,写出反应的离子方程式: 。
(3)举出实例说明硫单质的氧化性比x的氧化性弱(用化学方程式表示,反应类型为:置换反应)。 。
(4)气体(CN)2与x化学性质相似,也能与H2反应生成HCN(其水溶液是一种弱酸)。
用离子方程式表示0.1mol/L的KCN溶液显碱性的原因: 。离子浓度大小的顺序是(由大到小) 。
20.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
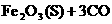 =====
=====
①反应的平衡常数表达式为:K= 。
②该温度下,在2L盛有Fe2O,粉末的密闭容器中通人CO气体,则10min内CO2的平均反应速率为0.015mol/(L.min),10min后生成了单质铁 g。
(2)可用上述反应中某种物理量来说明该反应已达到平衡状态的是 。
A.CO的生成速率与CO2的生成速率相等
B.CO生成速率与CO2消耗速率相等
C.CO的质量不变
D.体系的压强不再发生变化
E.气体密度不再变化
(3)写出氢氧化铝在水中发生酸式电离的电离方程式: 。
欲使上述体系中Al3+浓度增加,可加入的物质是 。
A.NaOH B.HCl C.NH3 D.NaHSO4
19.(14分)下表为元素周期表的一部分,请参照①~⑧在表中的位置,用化学用语回答下列问题:
|
(1)③和④的第一电离能大小 。
(2)④、⑤、⑥的离子半径由大到小的顺序为 。
(3)②、⑦、⑧的最高价氧化物的水化物的酸性由强到弱的顺序是 。
(4)写出①、④、⑧按1:1:1形成的化合物的电子式: 。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为 ,N(电解其熔融物)→⑥的单质的化学方程式为 。常温下,为使0.1 mol/L.M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 。
18.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传到Li+的高分子材料。这种锂
|
离子电池的电池反应为:Li+2Li0.35NiO2 2Li0.85NiO2。下列说法正确的是( )
2Li0.85NiO2。下列说法正确的是( )
A.放电时,负极的电极反应式为: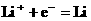
B.充电时,Li发生氧化反应
C.该电池不能用水溶液作为电解质
D.放电过程中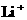 向负极移动
向负极移动
第Ⅱ卷(非选择题 共56分)
17.关于下列三种有机物的说法正确的是 ( )
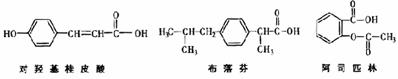
A.三种有机物均有苯环能与浓溴水发生加成反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多
D.使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物
16.将足量NH3通入 和
和 的混合稀溶液中,生成沉淀的物质的量(
的混合稀溶液中,生成沉淀的物质的量( )和通入
)和通入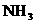 的体积(V)的关系正确的是 ( )
的体积(V)的关系正确的是 ( )
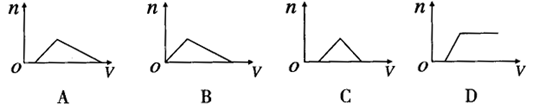
15.咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下
所示:关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为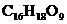
B.与两个6元环直接相连的原子都在同一平面上
C.1 mol 咖啡鞣酸水解时可消耗8mol NaOH
D.与浓溴水能发生加成反应,但不能发生取代反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com