
题目列表(包括答案和解析)
8.下列物质与其用途相符合的是
 ( )
( )
①N2-保护气 ②SiO2-光导纤维 ③AgI-人工降雨
④碘-预防甲状腺肿大 ⑤Al2O3-耐火材料 ⑥NaClO-消毒剂
A.②③④⑤⑥ B.①②③④⑤ C.②③④⑤ D.全部
7.在下列各溶液中,离子一定能大量共存的是 ( )
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.含有0.1 mol·L-1Ca2+溶液在中:Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SO42-
6.下列反应的离子方程式中正确的是 ( )
A.向Ba(OH)2溶液中加入过量NaHSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O
B.含0.1molFeI2的溶液中滴加含0.05molCl2的氯水:2Fe2++4I-+3Cl2═2Fe3++6Cl-+2I2
C.氯化铝溶液中滴加过量的氨水:Al3++3NH3·H2O═Al(OH)3↓+3NH+4
D.小苏打与少量Ca(OH)2溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O
5.将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+,Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,有关说法正确的是( )
A.还原性Cr3+ >Fe2+>SO2 B.氧化性Cr2O72->SO2>Fe3+
C.两个反应中Fe2(SO4)3均作还原剂 D.Cr2O72-能将Na2SO3氧化成Na2SO4
4.X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序
数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是( )
A.原子半径的大小顺序:X >Y>Z
B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的化合物制取Y单质
D.Y、Z元素的最高价氧化物对应的水化物不能互相反应
3.据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,
其中Pt为+5价,对于此反应,下列叙述正确的是( )
A.在此反应中,每生成1molO2(PtF6)则转移1mol电子B.在此反应中,O2是氧化剂,PtF6是还原剂
C.O2(PtF6)中氧元素的化合价是+1价 D.O2(PtF6)中仅存在离子键不存在共价键学
2.NA代表阿伏加德罗常数,下列叙述错误的是( )
A.10ml质量分数为98%的H2SO4,用水稀释至100ml,H2SO4的质量分数为9.8%
B.在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.一定温度下,1L0.50mol·L-1NH4Cl溶液与2L0.25 mol·L-1NH4Cl溶液含NH4+物质的量不同
1.物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具
有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是 ( )
A.常温下,“纳米铜”比铜片的金属性强 B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”与铜片的还原性相同 D.常温下,“纳米铜”比铜片的氧化性强
23.(8分)某粗铜中各成分的质量分数分别为:Cu:64%,Fe:5.6%,Zn:6.5%,Ni:5.9%,其余为Ag和Au,利用该粗铜电解精炼铜,电解液选择lL lmol/L的硫酸铜溶液,当通电30min(电流强度5.36A)(10ml电子的电量为96500库仑),(假设电解前后溶液体积相同)问:
(1)阴极质量增重多少克?
(2)阳极质量减轻多少克?
(3)此时溶液中铜离子的物质的量浓度为多少mol/L?(保留3位有效数字)
(4)此时溶液中Fe2+的物质的量浓度为多少mol/L?(保留3位有效数字)
22.(14分)氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:(已知:Fe(OH)2、Fe(OH)3、Cu(OH)2开始沉淀的pH分别为:6.5、3.5、5.4;沉淀完全时的pH分别为:9.6、3.7、6.4)
(1)制备氧化铜:工业 溶液CuSO4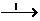
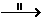 CuSO4
CuSO4 CuSO4·5H2O→→CuO
CuSO4·5H2O→→CuO
①步骤I的目的是除不溶性杂质。操作I中用到的玻璃仪器是 。
②步骤Ⅱ的操作是:滴加H2O2溶液,稍加热;再慢慢加入某试剂,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至:pH=1。步骤Ⅱ中的目的是 。控制溶液pH=3.5试剂是 。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是:蒸发浓缩,当溶液表面有晶膜出现时,冷却结晶。过滤,因CuSO4·5H2O直接用酒精灯加热易分解,我们可以采用加热烘干。这种加热的特点是 。
(2)探究氧化铜的性质
①取A、B两支试管,往A中先加人适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡。结论是 。
②为探究试管A中反应的速率,需要测定的物理量是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com