
题目列表(包括答案和解析)
2. 下列说法正确的是
A.用粮食酿酒的过程中,不可能生成乙酸
B.蛋白质、橡胶和塑料都是天然高分子
C.煤的干馏产物中不含烃
D.乙烯能使溴的四氯化碳溶液褪色,与乙烯分子含有碳碳双键有关
1.常温下,将等物质的量浓度、等体积的烧碱溶液和乙酸溶液混合,充分反应后溶液的pH
A.小于7 B.大于7 C.等于7 D.无法判断
29、(11分)某小组利用乙炔与酸性高锰酸钾溶液反应,测定乙炔的相对分子质量,下图是测定装置示意图。
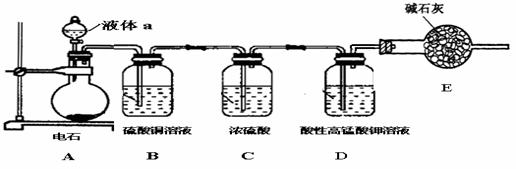
(1)硫酸铜溶液的作用是
(2)配平方程式
C2H2+ KMnO4+ H2SO4= K2SO4+ MnSO4+ CO2+ H2O
(3)实验前,D装置中KMnO4的物质的量为X mol。实验完毕,D及E装置共增重Yg,此时D中过量的KMnO4恰好能与含Z mol FeSO4的溶液完全反应(注:反应中MnO4-被还原成Mn2+,Fe2+被氧化成Fe3+)。则所测乙炔的相对分子质量是
(请用含字母X、Y、Z的代数式表示)。
(4)若该小组的实验原理及所有操作均正确,则下列各因素对所测乙炔的相对分子质量没有影响的是
A、装置A中产生的气体直接通入酸性高锰酸钾溶液中
B、乙炔通过酸性高锰酸钾溶液的速率过快,少量乙炔未被氧化而逸出
C、将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
(5)该课外小组的一位同学认为,该实验装置及实验操作均存在不足,请用简洁文字说明应采取何种改进措施:
。
28、(12分)如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:
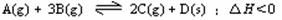
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是
A.混合气体的总质量不随时间改变;
B.2v正(C)=3v逆(B); C.A、B转化率相等;
D.物质D的质量不随时间改变;
(2)2min后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时容器的体积为 mL,B的转化率α甲(B)为 .
(3)乙容器中反应达到平衡所需要的时间 2min(填“>”、“<”或“=”,下同),B的转化率α乙(B) α甲(B)
(4)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C) mol,加入D的物质的量n(D)应该满足的条件为 。
27、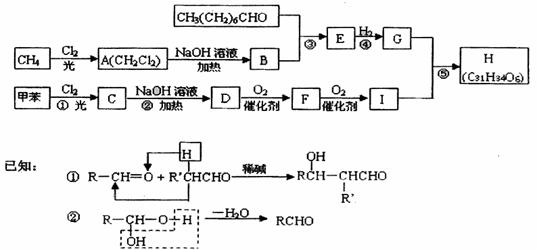 (17分) 一种用于治疗高血脂的新药灭脂灵可按如下路线合成:
(17分) 一种用于治疗高血脂的新药灭脂灵可按如下路线合成:
又知G的分子式为C10H22O3,试回答:
(1)反应①~⑤中属于取代反应有 (填写编号)。
(2)写出B、E的结构简式:B ,E 。
(3)写出与I互为同分异构体,且既含有苯环又能发生银镜反应的物质的结构简式(写两种即可) 、 。
(4)反应②方程式为 。
 (5)反应⑤方程式为
。
(5)反应⑤方程式为
。
26、(10分)下图中,A、C是工业上上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
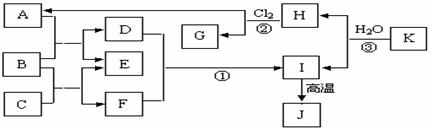
请按要求回答:
(1)写出B的化学式 ,G的电子式 。
(2) 反应①的离子方程式为 ;
(3) 反应②进行的条件是 ;
(4)反应③的化学方程式为 。
25.向某密闭容器中加人0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0-tl阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3-t4阶段为使用催化剂。下列说法中不正确的是
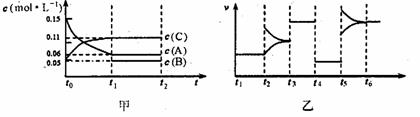
A.若tl=15s,则用C的浓度变化表示的t0-tl段的平均反应速率为0.004mol・L-1・S-1
B.以t4-t5阶段改变的条件一定为减小压强
C.该容器的容积为2 L, B的起始物质的量为0.02mo1.
D.t5-t6阶段,容器内A的物质的量减少了0.03mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为:3A(g) B(g) + 2C(g);△H =+100a kJ・mo1-1
B(g) + 2C(g);△H =+100a kJ・mo1-1
第Ⅱ卷(客观题50分)
24.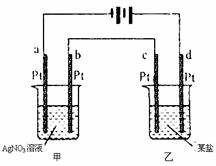 如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.24g某金属,下列说法正确的是
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.24g某金属,下列说法正确的是
A.甲池是b极上析出金属银,乙池是c极上析出某金属
B.甲池是a极上析出金属银,乙池是d极上析出某金属
C.某盐溶液可能是CuSO4溶液
D.某盐溶液可能是Mg(NO3)2溶液
23.在铁粉和铜粉的均匀混合物中加入某浓度的硝酸,充分反应,硝酸的还原产物只有NO。当加入硝酸10 mL时,剩余金属1.8 g,生成气体0.224 L;再增加硝酸10mL时,剩余金属0.96 g,又有0.224 L气体生成;继续增加硝酸10 mL时,金属全部溶解,又有0.224 L气体生成(以上体积均换算为标准状况下)。下列说法不正确的是
A.所加入硝酸的浓度是4 mol/L.
B.加入硝酸l0 mL时,剩余金属为铁和铜
C.共加入硝酸20 mL时,剩余金属只有铜
D.如果在金属混合物中共加入硝酸40 mL时,生成的NO仍是0.672 L(标准状况)
22. 在密闭容器中进行的可逆反应为:2NO2(g) N2O4(g);△H<0。一定条件下达到平衡后,改变下列条件的有关判断错误的是
在密闭容器中进行的可逆反应为:2NO2(g) N2O4(g);△H<0。一定条件下达到平衡后,改变下列条件的有关判断错误的是
A.保持容积不变,充入NO2,平衡向右移动,NO2的体积分数减小
B.保持容积不变,充入N2O4,平衡向左移动,NO2的体积分数增大
C.保持容积不变,升高温度,容器中气体颜色加深
D.保持容积不变,充入N2使容器中压强增大,上述平衡不移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com