
题目列表(包括答案和解析)
11.(江苏省黄桥中学2010届高三期中考试(化学))随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
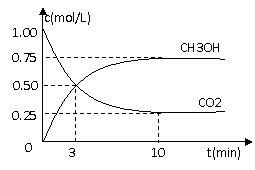
⑴.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CH3OH(g)+H2O(g);△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min).
②该反应的平衡常数表达式为__________________.
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵.在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O,则阴极反应式为________________________________.
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由______________________________________________.
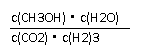 ⑴.①.0.225 ②.
③.C、D
⑴.①.0.225 ②.
③.C、D
⑵.2CO2+4e―+2H2O=2 CO+4OH―
不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行
10.(江苏省海安高级中学2010届高三10月月考(化学))下图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去)。



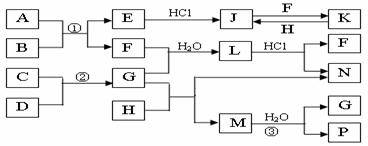
已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)F的化学式 ;G的水溶液中,最多的阳离子是 。
(2)写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释
。
(1)SO2 NH4+ (各2分,共4分)
(2)2Fe2++ Cl2=2 Fe3+ + 2Cl- (2分) 4NH3+3Cl2=NCl3+3NH4Cl (2分)
(3)饱和H水溶液中存在平衡:Cl2+H2O H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
1.5×10-3mol·L-1·s-1 …………………………………………………2分
(3)b c …………………………………………………………………2分
(4) 2NO(g)+O2(g) 2NO2(g) ΔH= -112.6 kJ ………………2分
2NO2(g) ΔH= -112.6 kJ ………………2分
(5)c …………………………………………………………………2分
9.(江苏省高淳中学2010届高三上学期调研(化学))在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
⑴写出该反应的平衡常数表达式:K= 。
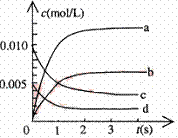 ⑵右图中表示NO2的变化的曲线是
。
⑵右图中表示NO2的变化的曲线是
。
用O2表示从0~2s内该反应的平均速率v= 。
⑶能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
⑷某同学查阅资料得知,该反应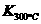 >
>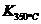 ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为
。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为
。
⑸ 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(1)K=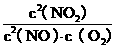 ………………………………………2分
………………………………………2分
(2)b …………………………………………………………………2分
8.(江苏省高淳中学2010届高三上学期调研(化学))硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O。下列各组实验中最先出现浑浊的是
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
7.(江苏省赣榆一中2010届高三12月阶段考试化学)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s-40s内用N2O4表示的平均反应速率为 mol/(L.s)
②计算在80℃时该反应的平衡常数K= ;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(1)①0.0020 (1分);②1.8 (1分); ③变浅 (1分); ④ D (1分)
(2)①14HNO3+3Cu2O==6Cu(NO3)2+2NO↑+7H2O (1分)
②0.6mol(1分)
③使用了较浓的硝酸,产物中有部分二氧化氮生成(1分)
6.(江苏省赣榆一中2010届高三12月阶段考试化学)一定温度下可逆反应:A(s)+2B(g) C(g)+D(g) △H<0。现将1mol A和2molB加入甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
C(g)+D(g) △H<0。现将1mol A和2molB加入甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
A.保持温度和活塞位置不变,甲中再加入1 mol A和2molB,达到新的平衡后,c(B)甲=c(B)乙
B.保持温度和乙中压强不变 ,向乙中加入2 mol D,达到新平衡 后,c(B) 乙≤2c(B) 甲
C.若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7%
D.保持活塞位置不变,升高温度,达到新的平衡后甲、乙中B的体积分数均增大

|
|
 P
P

5.(江苏省丹阳高级中学2010届高三上学期期中考试(化学))利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K= 。
(1)CH4(g)+H2O(g)=CO(g)+3H2(g); △H =+206.1 kJ·mol-1(2分)
(2) (2分)
(2分)
4.(江苏金陵中学高三年级期中考试题--化学)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:

a.6CO2+6H2O C6H12O6+6O2

b.CO2+3H2 CH3OH+H2O

c.CO2+CH4 CH3COOH

d.2CO2+6H2 CH2==CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
 CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
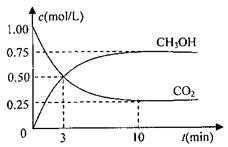 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
 N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol
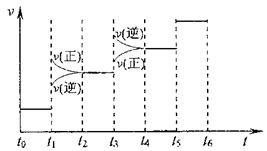 ①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将2amolH2和amolN2放入右图所示的密闭容器中,如果活塞能左右自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将2amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为 。
(1)保护臭氧层
(2)a c
(3)①0.225
②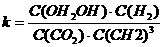 减小
减小
③CD
(4)加压 t2~t3
3.(江苏金陵中学高三年级期中考试题--化学)取5等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
 2NO2(g) N2O4(g),△H<0。反应相同时间后,分别测定体系中O2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 (
BD
)
2NO2(g) N2O4(g),△H<0。反应相同时间后,分别测定体系中O2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 (
BD
)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com