
题目列表(包括答案和解析)
21.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)(10分)下图是工业生产硝酸铵的流程。
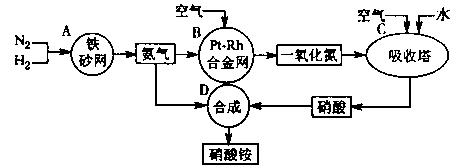
(1)吸收塔C中通入空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= -1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,
氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)  2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。
(1)使NO全部转化成HNO3 ABC
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.8kJ/mol
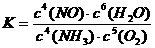
(3)CDE
(4)30%(或29.9%)
20.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)一定温度下,分别往容积均为5L的甲(恒压容器)、乙(恒容容器)中加入0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到2s时,测得乙容器中N2O4的浓度为0.09mol·L-1。经过60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因(用化学方程式表示)是: 。
(2)前2s内乙容器中以N204的浓度变化表示的反应速率为 。
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,以下同);容器N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
(4)若要使甲、乙中N2O4浓度相等,不能采取的措施是 (填选项的标号)。
A.保持温度不变,适当压缩甲容器体积 B.保持容器体积不变,使甲容器升温
C·保持容器体积和温度不变,向甲容器中加入适量 N204
(1)N2O4 2NO2
2NO2
(2)0.005mol/(L.S)
(3)大于 小于 大于
(4)B
19.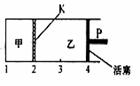 (江苏省江浦高级中学高三化学2010第一轮复习模块检测)已知可逆反应:A(s)+2B(g)
(江苏省江浦高级中学高三化学2010第一轮复习模块检测)已知可逆反应:A(s)+2B(g) C(g)+D(g) △H<0。在一定温度下将1mol
A和2molB加入如右图所示甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
C(g)+D(g) △H<0。在一定温度下将1mol
A和2molB加入如右图所示甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
A.保持温度和活塞位置不变,甲中再加入1 mol A和2mol B,达到新的平衡后,c(B)甲=2c(B)乙
B.保持温度和乙中压强不变 ,向乙中再加入2 mol D,达到新平衡后,c(B) 乙>c(B) 甲
C.若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7%
D.保持乙中压强不变 ,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
18. (江苏省江浦高级中学高三化学2010第一轮复习模块检测)某密闭容器中加入0.3 molA 、0.1 molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~ t1阶段 c ( B)未画出]。图乙为t2后改变互不相同的某一条件反应速率跟时间的关系,已知,t3 ~t4阶段使用催化剂。下列说法正确的是
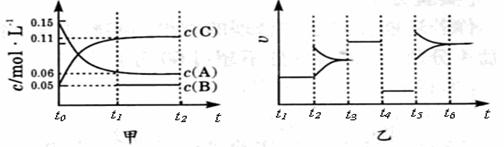
A.若 t1= 15 s,生成物C在 t0~ t1时间段的平均反应速率为 0.004mol·L-1·s-1
B.t4 ~t5阶段改变的条件为降低反应温度
 C.B的起始物质的量为 0.02mol D.t5 ~t6改变的条件是增大反应物浓度
C.B的起始物质的量为 0.02mol D.t5 ~t6改变的条件是增大反应物浓度
17.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)一定温度下,将2mol PCl3和 1mol Cl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2
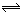 PCl5。各物质均为气态。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3
和0.5mol Cl2,相同温度下达到平衡,PCl5的物质的量为:
A.0.4mol
B.0.2mol C.0.2<x<0.4mol
D.<0.2mol
PCl5。各物质均为气态。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3
和0.5mol Cl2,相同温度下达到平衡,PCl5的物质的量为:
A.0.4mol
B.0.2mol C.0.2<x<0.4mol
D.<0.2mol
15.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)已知:4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g),△H = -1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( C )
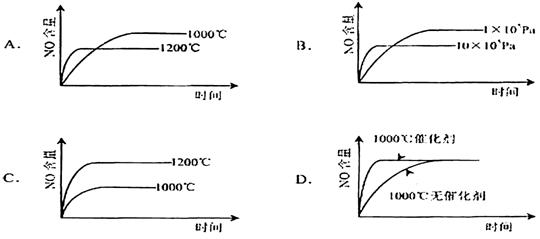
14.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)下列方法中可以说明2HI(g)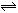 H2(g)+I2(g)已达到平衡的是:
H2(g)+I2(g)已达到平衡的是:
①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。
A、②③⑤ B、①④⑦ C、②⑦⑨ D、⑧⑨⑩
13.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)在一定温度下,反应A2(g) + B2 (g) 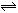 2AB(g)达到平衡的标志是:
2AB(g)达到平衡的标志是:
A、单位时间生成n mol A2同时生成n mol AB B、容器内总压不随时间变化
C、单位时间生成2n mol AB同时生成n mol B2 D、单位时间生成n mol A2同时生成n mol B2
12.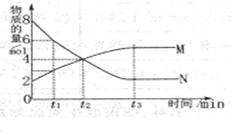 (江苏省江浦高级中学高三化学2010第一轮复习模块检测)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是:
(江苏省江浦高级中学高三化学2010第一轮复习模块检测)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是:
A.反应的化学方程式为:2M≒N
B.t2时,正逆反应速率相等,达到平衡
C.t3正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com