
题目列表(包括答案和解析)
1.(姜堰市罗塘中学2009-2010学年第一学期期中考试高三化学试题)海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。
试回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法。
你认为蒸馏法海水淡化最理想的能源是 ▲ 。
(2)从海水中可得到多种化工原料和产品。下列是海水资源利用的流程图。
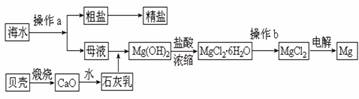
①流程图中操作a的名称为 ▲ 。
②工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。气体A、B是CO2或NH3,则气体B应是 ▲ 。(填化学式)
③镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
a.若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是: ▲ 。
b.操作b是在 ▲ 气氛中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式 ▲ 。
c.在母液苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中Mg元素的含量(g/L),实验过程中应测定的数据有 ▲ 。
⑴太阳能等(1分)。
⑵ ①蒸发结晶(或蒸发1分)
② CO2(1分)
③a.用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。(2分)(答焰色反应也给分)
b.HCl(或氯化氢)(1分) MgCl2·6H2O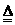 Mg(OH)Cl + HCl↑+5H2O(2分)
Mg(OH)Cl + HCl↑+5H2O(2分)
c.苦卤样品的体积、Mg(OH)2沉淀的质量(2分)
9.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)在由Fe、FeO、和Fe2O3组成的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是:
A.混合物里3种物质反应时消耗盐盐酸的物质的量浓度之比为1:1:3
B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:2
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
8.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)白云石化学式为CaCO3·x MgCO3。以它为原料,可制取耐火材料MgO等。称取27.6
g白云石样品,高温加热到质量不再变化,收集到CO2的体积为6.72 L(标准状况)。下列说法正确的是:
A.x=1 B.x=2
C.该样品高温条件下充分反应后剩余固体的质量是14.4g
D.该样品高温条件下充分反应后剩余固体中MgO的质量是4.0g
7.(江苏省黄桥中学2010届高三期中考试(化学))FeCl3可用作印刷电路铜板腐蚀剂。为回收废腐蚀液中的铜,必须对废腐蚀液的组成进行分析。某同学取废腐蚀液200mL,分成甲、乙两等份。向甲溶液中滴加AgNO3溶液至不再有沉淀产生,得到沉淀129.15g;向乙溶液中加入10g足量铁粉,充分反应,剩余固体质量4.8g。计算中忽略溶液体积的变化。
⑴写出FeCl3溶液腐蚀印刷电路铜板的离子方程式,并标出电子转移的方向和数目 。
⑵废腐蚀液中含有的Cl-离子的物质的量浓度是 。
⑶计算废腐蚀液中铜离子的物质的量浓度(写出计算过程)。
⑴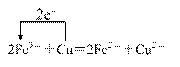 (4分)
(4分)
⑵9mol·L-1 (4分)
⑶n(Cu)×64g/mol+10g-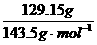 ×
× ×
×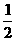 ×56g/mol=4.8g
×56g/mol=4.8g
n(Cu)=0.05mol n(CuCl2)=n(Cu)=0.05mol
c(Cu2+)=0.05mol÷0.1L=0.5mol/L (2分)
6.(江苏省赣榆一中2010届高三12月阶段考试化学)某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
5.(江苏省丹阳高级中学2010届高三上学期期中考试(化学))在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入b mol的BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c molNH3,则原溶液中的Al3+的浓度(mol/L)为 ( )
A.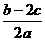 B.
B. C.
C. D.
D.
4.(江苏金陵中学高三年级期中考试题--化学)向一定量的Fe、FeO和Fe2O3的混合物中加入120mL4mol/L和稀硝酸,恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热条件下充分还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.19mol D.0.14mol
3.(如皋市2010届高三综合测试)我省东海有一种形态酷似水蛭的蛭石,是一种层状结构的含镁的铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
(1)某硅酸盐矿石的组成可以看作SiO2中有1/4的Si被Al替换,再由Mg平衡其电荷形成的。该矿石的组成以氧化物形式表示为 。
(2)某校研究性学习小组取得了某种牌号的蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
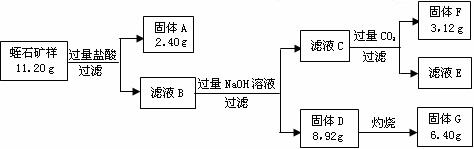
① 固体A的化学式是 ;
② 固体F的物质的量是 ;
③ 通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式(必须有计算过程)。
(1)MgO·Al2O3·6SiO2 (2分)
(2)① SiO2 (2分)
② 0.040mol (2分)
③ n(SiO2)= = 0.04mol
设 固体G中Fe2O3的物质的量为x mol,MgO的物质的量为y mol
依题意有:
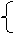 160x+40 y=6.40
160x+40 y=6.40
214x+58 y=8.92
解得:x=0.020 mol y=0.080 mol (2分)
由②知: n(Al2O3)=0.020mol
于是n(H2O)= (11.20-40×0.08-60×0.04-160×0.020-102×0.020)÷18=0.02 (mol)
则: n(MgO )︰n(Fe2O3)︰n(Al2O3)︰n(SiO2)︰n(H2O)
==0.080mol︰0.020mol︰0.020mol︰0.04mol︰0.02mol
==8︰2︰2︰4︰2
==4︰1︰1︰2︰1
即该蛭石矿的组成为: 4MgO·Al2O3·Fe2O3·2SiO2·H2O(不化简扣1分) (2分)
2.(姜堰市罗塘中学2009-2010学年第一学期期中考试高三化学试题)为了测定某铜银合金的成分,将30.0g该合金溶于80.0mL浓度为13.5mol/L的浓HNO3中,待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的c(H+)=1.0mol/L。假设反应后溶液的体积仍为80.0mL,试计算:
(1)被还原的硝酸的物质的量。
(2)合金中铜的质量分数。
(3)6.72L(标准状况)气体的组成。
(1) 0.3mol (3分) (2)64.0% (3分)
(3) V(NO2)=2.24L , V(NO)=4.48L (共4分)
1. (江苏省赣榆一中2010届高三12月阶段考试化学)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
(江苏省赣榆一中2010届高三12月阶段考试化学)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质的量。试回答下列问题。写出在酸性介质中用NaClO3氧化FeSO4·7H2O的离子方程式
(1)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48 g , 向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度。
(2)计算出该固体聚合硫酸铁样品的化学式。
6Fe2++ClO3-+6H+===6Fe3++Cl-+3H2O (2分)
解:(1)n(Fe)=2.80g/160g·mol-1×2=0.035mol
n(SO42-)=10.48 g /233 g·mol-1=0.045mol
n(OH-)=3×n(Fe)-2×n(SO42-)=3×0.035-2×0.045=0.015mol (3分)
盐基度=n(OH-)/3n(Fe)×100%
= 0.015 mol/(3×0.035 mol) ×100%=14.29% (2分)
(2)(3分)
n(H2O)=(7.51g-0.035mol×56g·mol -1-0.045mol×96 g·mol-1-0.015mol×17g·mol-1)/18 g·mol-1=0.054 mol (2分)
化学式: Fe35(OH)15(SO4)45·54H2O (1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com