
题目列表(包括答案和解析)
5、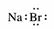 下列化学用语正确的是( )
下列化学用语正确的是( )
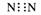 A.氮分子的电子式: B.溴化钠的电子式:
A.氮分子的电子式: B.溴化钠的电子式:
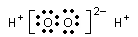
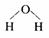
C.过氧化氢 D.水分子的结构式:
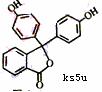
4、指示剂酚酞的结构简式如下图,下列说法正确的是
A.能溶于水 B、1摩尔酚酞能与4摩尔NaOH反应
C、不能发生加成反应 D、能与浓溴水反应生成白色沉淀
3、下列颜色变化与化学反应无关的是 ( )
① 碘遇淀粉显蓝色;② 苯酚晶体空气中变红色;③ 二氧化硫使品红溶液褪色;
④ 酸碱指示剂遇酸或碱变色;⑤ 活性炭使NO2气体褪色。
 A、①②④
B、①②⑤
C、只有⑤
D、②④⑤
A、①②④
B、①②⑤
C、只有⑤
D、②④⑤
2、下列依据热化学方程式得出的结论正确的是
A.已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定
B.已知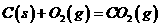 ;
;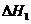 C(s)+1/2
C(s)+1/2  =CO(g);
=CO(g);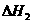 ,则
,则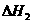 >
>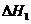
C.已知2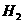 (g)+
(g)+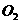 (g)=
(g)=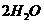 (g);△H =-483.6kJ/mol,则氧气的燃烧热为24l.8kJ/mol
(g);△H =-483.6kJ/mol,则氧气的燃烧热为24l.8kJ/mol
D.已知 (
(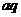 )+
)+ (
(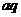 )=
)=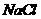 (
(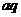 )+
)+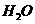 (
(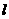 )△H =-57.3kJ/mol,则含20g
)△H =-57.3kJ/mol,则含20g 的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol
的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol
1、2007年诺贝尔化学奖授予德国化学家格哈德﹒埃特尔,以表彰他在“表面化学”研究领域作出的开创性贡献。其中催化剂是表面化学研究的重要方面,据报道,美国已经找到名为Trans的铁系催化剂,使氮气和氢气能在常温常压下合成氨。该催化剂的作用是:
A、使反应物的化学键不需破坏
B、降低生产能耗
C、使反应更完全
D、使反应放出更多的热量
6.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)下图是工业生产硝酸铵的流程。
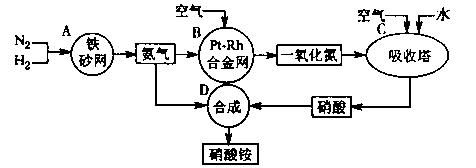
(1)吸收塔C中通入空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= -1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,
氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)  2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。
(1)使NO全部转化成HNO3 ABC
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.8kJ/mol
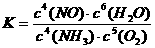
(3)CDE
(4)30%(或29.9%)
5.(江苏省黄桥中学2010届高三期中考试(化学))坐落在山东沿海地区的潍坊纯碱厂是我国重点大型企业,其生产工艺沿用我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
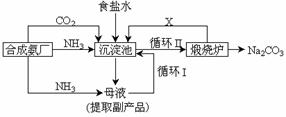
①上述生产纯碱的方法称 ,副产品的一种用途为 。
②沉淀池中发生的化学反应方程式是 。
③写出上述流程中X物质的分子式 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
①联合制碱法或侯德榜制碱法 ,化肥或电解液或焊药等(2分)
②NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓ (2分)
③CO2 (1分)
④I (1分)
⑤ A、C
4.(江苏省海安高级中学2010届高三10月月考(化学))医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
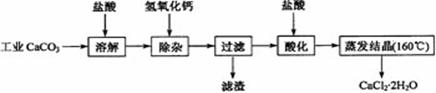
⑴除杂操作是加入氢氧化钙,调节溶液的pH为8.0~5.0,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是 。
⑵酸化操作是加入盐酸,调节溶液的pH约为4.0,起目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
⑶测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.0500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有 。
②计算上述样品中CaCl2·2H2O的质量分数为 。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ; 。
⑴取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全
⑵防止溶液吸收空气中的CO2
⑶①酸式滴定管
②99.9%
③样品中存在少量的NaCl 少量CaCl2·2H2O失水
3.(江苏省赣榆一中2010届高三12月阶段考试化学)工业碳酸钠(纯度约为 98 % )中含有 Ca2+、 Mg2+、 Fe3+、 Cl-和 SO42-等杂质,提纯工艺线路如下:
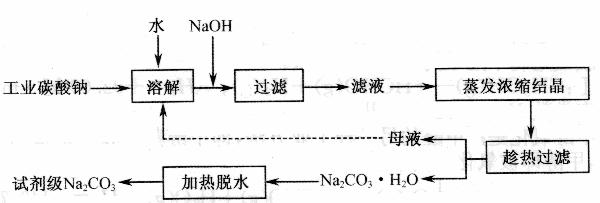
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
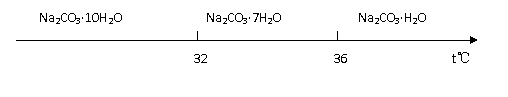

Ⅱ.有关物质的溶度积如下
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe(OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1) 加入NaOH溶液时,反应的离子方程式为 。
向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,
c(Mg 2+)∶c(Fe3+)==
( 2 ) “母液”中除了含有 Na+、 CO32-离子外 ,还含有 等离子。
( 3 )有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析实际工业生产中是否可行 (填“可行”或“不可行”)并说明理由 。
( 4 )已知: Na2CO3 ·10H2O ( s ) ==Na2CO3 ( s ) + 10H2O ( g ) △H==+532 .36 kJ·mol-1
Na2CO3 ·10H2O ( s ) ==Na2CO3·H2O ( s ) + 9H2 O( g ) : △H =+473 . 63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式
( l ) MgCO3 + 2OH-== Mg(OH )2+ CO32-( 2 分)(说明:书写 Fe3++ 3OH-= Fe ( OH )3↓、 Mg2++ 2OH-== Mg(OH )2↓不扣分,但也不得分) 2 .125×1021 , ( 2 分)
( 2 ) Cl-、 SO42-( 2 分,写出一个得 1 分,只要写错一个不得分)
( 3 )不可行( 2分)
若“母液”循环使用,则溶液: c(Cl-)和c(SO42-)增大,最后所得产物 Na2 CO3 混有杂质(2分)
( 4 ) Na2 CO3·H2O ( s )== Na2 CO3( s ) + H2O ( g ) ; △ H =+58 . 73kJ·mol-1 ( 2 分)
2.(江苏金陵中学高三年级期中考试题--化学)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
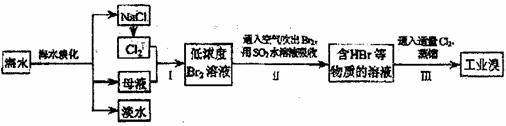
(1)请列举海水淡化的一种方法: 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2 。
(3)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的为 。
(4)步骤II用SO2水溶液吸收Br2,吸收速率可达95%,有关该反应的离子方程式为
。由此反应可知,除保护环境外,在工业生产中还应解决的问题是 。
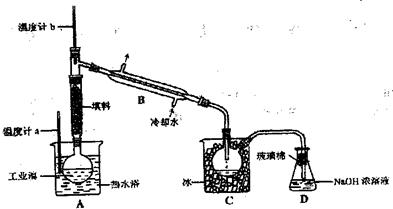 (5)某化学研究性学习小组为了了解从工业溴水中提纯溴的方法,查阅有关资料知Br2的沸点为59°C。微溶于水,有毒性和强腐蚀性。他们参观了有关生产过程后,设计了如下装置简图在实验室模拟工业提纯过程:
(5)某化学研究性学习小组为了了解从工业溴水中提纯溴的方法,查阅有关资料知Br2的沸点为59°C。微溶于水,有毒性和强腐蚀性。他们参观了有关生产过程后,设计了如下装置简图在实验室模拟工业提纯过程:
请你参与分析讨论:
①图中仪器B的名称是 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③若实验装置气密性良好,要达到提纯溴的目的,操作中需精确控制温度计 (填“a”或“b”)的温度为 °C时所收集的馏分即为纯溴。
④C中所得深的颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
(1)蒸馏法 渗析法 离子交换法
(2)Cl2、NaOH NaClO
(3)富集Br2、提高Br2的浓度
(4)SO2+H2O+Br2=4H++Br-+SO2-4
强酸对设备的腐蚀
(5)①冷凝管
②Br2会与橡胶反应,腐蚀橡胶
③b 59
④深红棕色 分液或蒸馏
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com