
题目列表(包括答案和解析)
15、 ⑴原子数目和电子总数(或价电子总数)相同的微粒互称等电子体,等电子体具有相似的结构特征。试写出短周期元素形成的含有14个电子的分子的化学式:_____________,其中_____和_____互为等电子体,CO分子的电子式为______________。
 ⑵CH3CHO分子中,-CH3中的碳原子采用________杂化方式,-CHO中的碳原子采取______杂化方式。
⑵CH3CHO分子中,-CH3中的碳原子采用________杂化方式,-CHO中的碳原子采取______杂化方式。
⑶2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
14、下列反应过程中,最终所得白色沉淀不一定是BaSO4的是
A.Fe(NO3)3溶液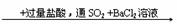 白色沉淀
白色沉淀
B.Ba(NO3)2溶液 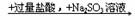 白色沉淀
白色沉淀
C.无色溶液 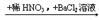 白色沉淀
白色沉淀
D.无色溶液  无色溶液
无色溶液  白色沉淀
白色沉淀
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13、500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为2 mol·L-1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
12、对于平衡体系:aA(g)+bB(g)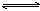 cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则起始时A、B的物质的量之比为a:b
C.若平衡体系中共有气体m mol,再向其中充入n molB,达到平衡时气体总物质的量为(m+n)mol,则a+b=c+d
D.若a+b=c+d ,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强不变
11、经测定某溶液中离子只有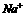 、
、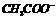 、
、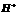 、
、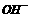 四种,且离子浓度大小的排列顺序为:c(
四种,且离子浓度大小的排列顺序为:c(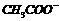 )>c(
)>c(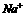 )>c(
)>c(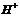 )>c(
)>c(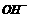 ),其可能的情况是
),其可能的情况是
A.该溶液可能由0.1mol/L的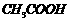 溶液与0.1mol/L的
溶液与0.1mol/L的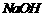 溶液等体积混合而成
溶液等体积混合而成
B.该溶液可以由pH=3的 与pH=11的
与pH=11的 溶液等体积混合而成
溶液等体积混合而成
C.该溶液中离子浓度的关系符合c(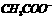 )+ c(
)+ c(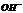 )>c(
)>c( )+ c(
)+ c(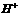 )
)
D.在上述溶液中加入适量 ,离子浓度大小可改变为c(
,离子浓度大小可改变为c(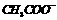 )>c(
)>c( )>c(
)>c(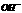 )>c(
)>c(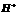 )
)
10、下列反应的离子方程式正确的是
A.Fe3O4与稀硝酸反应:Fe3O4+8H+ Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O
B.Na2S溶液呈碱性:S2-+2H2O H2S+2OH-
H2S+2OH-
C.向硝酸银溶液中逐滴滴入稀氨水直至过量:Ag++2NH3·H2O [Ag(NH3)2]++2H2O
[Ag(NH3)2]++2H2O
D.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH- CaCO3↓+CO32-+2H2O
CaCO3↓+CO32-+2H2O
9、锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( 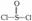 )中形成的,该电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,下列叙述中正确的是
)中形成的,该电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,下列叙述中正确的是
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1
8、某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:① 加入过量盐酸,有气体生成;② 在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。原溶液中一定存在的离子是 ( )
A、Al3+、Fe3+、SO42-
B、Na+、AlO2-、CO32-
C、Na+、AlO2-、SO42-、CO32-
D、Na+、Ba2+、AlO2-
7、下列实验操作中,错误的是
A、滴定时,防止溶液滴在锥形瓶外,滴定管尖嘴深入到锥形瓶中
B、加热坩埚中硫酸铜晶体,失水后须在干燥器中冷却,称量
C、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
6、几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是
A.L、M的单质与稀盐酸反应速率:M > L
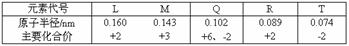 B.R的氧化物对应的水化物可能具有两性
B.R的氧化物对应的水化物可能具有两性
C.T、Q的氢化物常态下均为无色气体
D.L、Q形成的简单离子核外电子数相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com