
题目列表(包括答案和解析)
7、将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A.c(HCN)<c(CN-) B.c(Na+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D.c(HCN)+c(CN-)=0.1mol·L-1
6、化学实验中,常将溶液或试剂酸化,下列酸化处理的措施中正确的是
A.定性检验SO32-,将BaCl2溶液用HNO3酸化
B.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化
C.检验某溶液中是否含Cl– ,用HNO3酸化的AgNO3溶液
D.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
5、有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的
A.肯定有A13+、Mg2+、NH4+、Cl- B.肯定有A13+、Mg2+、HCO3-
C.肯定有K+、HCO3-、MnO4- D.肯定有A13+、Mg2+、SO42-
4、在密闭容器中,对于可逆反应A +3B  2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
A.若正反应方向△H <0,则T1> T 2 B.A一定为气体
C.压强增大时,混合气体的平均相对分子质量减小 D.B一定为气体
3、 ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为(
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为(
A.1︰1 B.2︰1 C.1︰2 D.2︰3
2、下列说法中正确的是
A.C60和C70的混合物共2.4 g,其中所含碳原子数为0.2 NA
B.0.1 mol 锌与100 mL 1mol/L 的稀盐酸充分反应,产生氢气的分子数为0.1 NA
C.将NO2和N2O4分子共NA个降温至标准状况下,其体积为22.4L
D.含0.1 mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数为0.2NA
1、将下列各组物质按酸、碱、盐顺序排列,正确的是
A.硫酸、纯碱、石灰石 B.醋酸、酒精、醋酸钠
C.亚硫酸、熟石灰、小苏打 D.石炭酸、熟石灰、漂白粉
8.在下列有关碳酸的盐溶液的说法中,不正确的是
A.在溶质物质的量相等的Na2CO3、NaHCO3 两溶液中,阴离子总数相等
B.常温下,等物质的量浓度的Na2CO3溶液中的pH值大于NaHCO3溶液的pH值
C.在Na2CO3溶液中一定有:c(Na+)十c(H+)=c(HCO )+c(OH-)十c(CO
)+c(OH-)十c(CO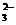 )
)
D.在NaHCO3溶液中一定有:c(Na+)>c(HCO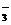 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
限时训练3
7.设NA为阿佛加德罗常数,下列叙述中正确的
A.标准状况下,22.4LSO2和O2混合气体中含有的氧原子数为2NA
B.0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA
C.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内气体分子总数为2NA
D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
6.将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g) △H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) △H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
|
|
改变条件 |
新平衡与原平衡比较 |
|
A |
升高温度 |
X的转化率变小 |
|
B |
增大压强 |
X的浓度变小 |
|
C |
充入一定量Y |
Y的转化率增大 |
|
D |
使用适当催化剂 |
X的体积分数变小 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com