
题目列表(包括答案和解析)
3. 实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸上颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI + Hg = Cu2HgI4 + 2Cu,下列说法正确的是
A.CuI在反应中失去电子 B.Cu2HgI4中Cu 元素的化合价为+2
C.CuI是氧化剂 D.1 molCuI 参与反应有1 mol电子转移
2.下列说法不科学的是
A. 臭氧是饮水的理想消毒剂之一,原因是臭氧杀菌能力强且又不影响水质
B. “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成可溶性Ca(HCO3)2的缘故
C. 实验室使用“通风橱”是不环保的做法,因为实验产生的有害气体并没有得到有效的处理
D. 变质的油脂有难闻的气味,是由于油脂与水发生了水解反应
1. 金属钛对人体体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关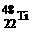 和
和 的说法中正确的是
的说法中正确的是
A. 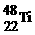 和
和 的质量数相同,互称为同位素
的质量数相同,互称为同位素
B. 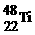 和
和 的质子数相同,互称同位素
的质子数相同,互称同位素
C. 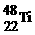 和
和 的质子数相同,是同一种核素
的质子数相同,是同一种核素
D. 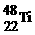 与
与 核外电子数相同,中子数不同,不能互称为同位素
核外电子数相同,中子数不同,不能互称为同位素
33.(16分)分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
|
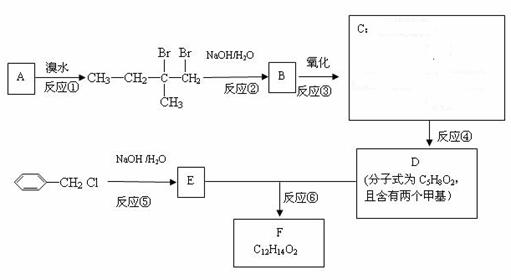
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现 种峰;
(2)C物质的官能团名称______;
(3)上述合成路线中属于取代反应的是 (填编号);
(4)写出反应④、⑥的化学方程式(不要求写出反应条件):
④ ,⑥ ;
(5)写出E属于芳香族化合物的2种同分异构体(不含E)的结构简式:
 。
。
广东省汕头市潮阳区2010届高三上学期统考
32. (16分) 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(16分) 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
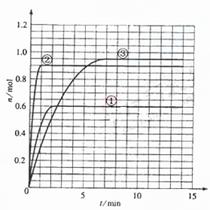
 (1)根据下表中数据,在由图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(1)根据下表中数据,在由图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
 1 1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
 (2)体系中发生反应的化学方程式是
。
(2)体系中发生反应的化学方程式是
。
(3)列式计算该反应在0-3min时间内产物Z的平均反应速率: 。
(4)该反应达到平衡时反应物X的转化率α等于 。
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:① ② ③ 。
31.(16分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2 △H=? 。
4Fe(OH)3+8OH-+3O2 △H=? 。
K2FeO4在处理水的过程中所起的作用有 。
 (2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定
c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。


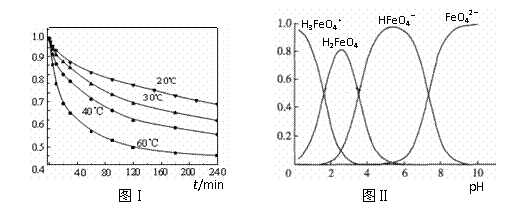
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤3:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1 (NH4)2Fe(SO4) 2标准溶液滴定至终点,消耗(NH4)2Fe(SO4) 2溶液V1 mL。滴定时发生的反应为:
Fe2++Cr2O72-+H+→Fe3++Cr3++H2O(未配平)
① 写出步骤2中发生反应的离子方程式 。
② 根据上述实验数据,测定该溶液中K2FeO4的浓度为 (用含字母的代数式表示)。
30. (16分)在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
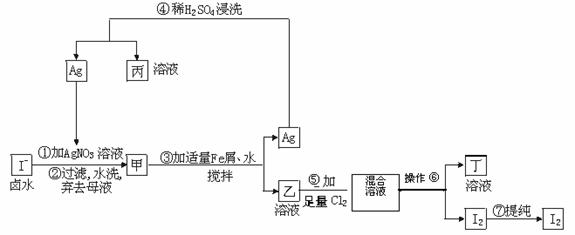
试回答:
(1) 甲物质见光易变黑,其原因是(用化学方程式表示) ,写出甲物质的两种主要用途 。
(2)步骤③加Fe粉的目的是 。
(3)写出步骤⑤中反应的离子方程式 。
(4) 操作⑥的名称是 ,该操作使用的主要仪器是 (填仪器名称),选用的试剂是 。
23.下列有关叙述中正确的有
A.标准状况下,2.24L CHCl3含有的分子数为0.1NA
B.向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸的离子反应方程式为:
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
C. 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:
Ba2++2OH-+SO42-+2H+=BaSO4↓+ 2H2O
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
22、氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如下图。

①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905 kJ·mol-1
4NO(g)+6H2O(g) △H=-905 kJ·mol-1
②4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1268 kJ·mol-1
2N2(g)+6H2O(g) △H=-1268 kJ·mol-1
下列说法中正确的是
A.工业上氨催化氧化生成 NO时,温度应控制在780-840℃之间
B.工业上采用物料比n(O2)/n(NH3)在1.7-2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.N2氧化为NO的热化学方程式为:
N2(g)+O2(g) 2NO(g) △H=+181.5 kJ·mol-1
2NO(g) △H=+181.5 kJ·mol-1
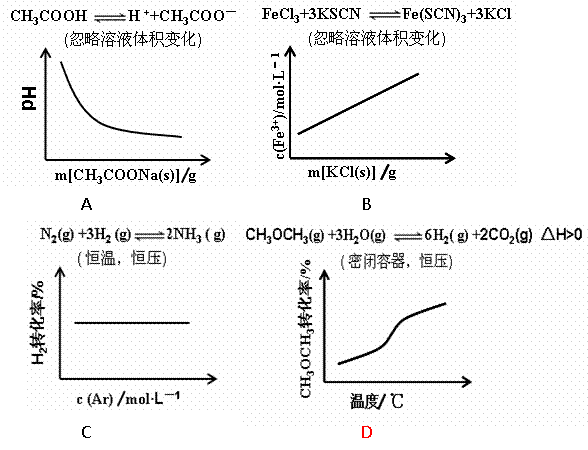
12、各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com