
题目列表(包括答案和解析)
13.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强 B.原子半径X>Y,离子半径X+>Z2-
C.同周期元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
12. 利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是
利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是
A.50-80℃时,适当增大压强,有利于Ni(CO)4的生成
B.利用上述原理提纯粗镍需要消耗大量的CO气体
C.50-200℃范围内,该反应的平衡常数随温度的升高而减小
D.该反应的平衡常数表达式是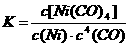
11.LiFePO4锂离子动力电池是奥运会绿色能源。该电池放电时的电极反应式为:
正极 FePO4+Li++e-==LiFePO4 负极 Li-e-== Li+ 。下列说法中正确的是
A.充电时,反应为FePO4+Li = LiFePO4
B.充电时,电池上标注“+”的电极应与外接电源的正极相连
C.放电时,在正极上是Li+ 得电子被还原
D.放电时,电池内部Li+ 向正极移动
10.下列分子中所有原子都满足最外层8电子结构的是
A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
9. 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq)+SO2-4+
Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1);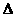 H=-57.3 kJ/mol
H=-57.3 kJ/mol
B.KOH(aq)+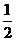 H2 SO4(aq)=
H2 SO4(aq)= 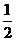 K2SO4(aq)+H2O(l);
K2SO4(aq)+H2O(l);
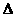 H=-57.3kJ/mol
H=-57.3kJ/mol
C.C8H18(g)+
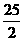 O2(g)=8CO2(g) + 9H2O(1);
O2(g)=8CO2(g) + 9H2O(1);
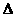 H=-5518 kJ/mol
H=-5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1);
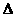 H=-5518 kJ/mol
H=-5518 kJ/mol
8.下列各组数据中,其比值为2 : 1的是
A.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH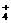 ): c(SO
): c(SO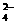 )
)
B.相同温度下,0.2mol /L乙酸溶液与0.1mol /L乙酸溶液中,c(H+)之比
C.Na2CO3溶液中,c(Na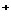 ): c(CO
): c(CO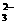 )
)
D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c(Ba(OH)2): c(KOH)
7.下列有关实验操作的说法正确的是
A.可用25ml碱式滴定管量取20.00ml KMnO4 溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全
6. W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是高.考.资.源.网
A.金属性:Y Z
B 氢化物的沸点:
Z
B 氢化物的沸点: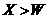 高.考.资.源.网
高.考.资.源.网
C.离子的还原性: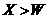 D 原子及离子半径:
D 原子及离子半径: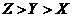 高.考.资.源.网
高.考.资.源.网
5.下列各组物质中,不是按 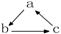 (“→”表示一步完成)关系相互转化的是:
(“→”表示一步完成)关系相互转化的是:
|
选项 |
A |
B |
C |
D |
|
a |
Fe |
CH2=CH2 |
HNO3 |
Al(OH)3 |
|
b |
FeCl3 |
CH3CH2Br |
NO |
NaAlO2 |
|
c |
FeCl2 |
CH3CH2OH |
NO2 |
Al2O3 |
4.设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,3.2g O3所含电子数为1.2NA
B.标准状况下,2.24LCCl4中含有的C-Cl键的数目为0.4NA
C.标准状况下,11.2L NO与11.2L O2 混合后所含原子数为2NA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com