
题目列表(包括答案和解析)
4.设NA代表阿伏加德罗常数的数值,下列说法正确的是
A. 标准状况下,22.4L乙醇的分子数为NA
B.2.4g金属镁变为镁离子时失去的电子数为1.2NA C.标准状况下, 22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
D.将1 mol FeCl3转化为Fe(OH)3胶体,Fe(OH)3胶粒数小于6.02×1023
3.只用一种试剂就可鉴别 (NH4)2SO4、NH4Cl、AlCl3、Na2SO4和NaCl五种溶液,这种试剂是 A.NaOH溶液 B.盐酸 C.Ba(OH)2 溶液 D.稀H2SO4
2.实验室里不宜长期放置,应现配现用的试剂是
①酚酞试液 ②银氨溶液 ③Cu(OH)2悬浊液 ④Na2CO3溶液 ⑤酸性FeCl3溶液
⑥FeSO4溶液 ⑦ 氯水 ⑧NaCl溶液 A.②④⑥⑧ B.②③⑥⑦ C.①②⑤⑦ D.②⑤⑥⑧
1.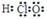 下列化学用语表达正确的是
A.中子数为20的氯原子符号为 1737Cl B.次氯酸的电子式为
下列化学用语表达正确的是
A.中子数为20的氯原子符号为 1737Cl B.次氯酸的电子式为
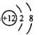 C.H、D、T互为同素异形体
D.镁的原子结构示意图
C.H、D、T互为同素异形体
D.镁的原子结构示意图
19.(12分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用 |
 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是 。
解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示) 。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
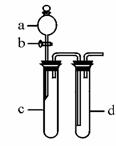
18.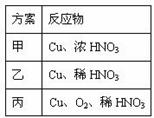 (12分)某兴趣小组设计出图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。(固定装置略去)
(12分)某兴趣小组设计出图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。(固定装置略去)
(1)实验前,如何检验该装置的气密性: 。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 。再由a向c中加2 mL蒸馏水,c中的实验现象是 。
(3)上表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 。理由是 。
(4)该小组还用上述装置进行实验证明氧化性:
KMnO4>Cl2>Br2。实验现象为 ;但此实验的不足之处是 。
17.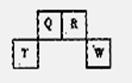 (10分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
(10分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为_______.
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
 (5)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(5)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
16.(16分)某溶液中可能含有CO32-、SO42-、 HCO3-三种离子中的一种或两种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,在小明实验的基础上做进一步的实验,对小明的实验给出结论。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯;lmol/L硫酸;2mol/L盐酸;2mol/L硝酸;lmol/L氯化钡、澄清石灰水、蒸馏水。完成下列探究过程:
(l)提出假设:
假设 l :溶液中只存在C032- 假设 2 :
假设 3 : 假设 4 :溶液中存在S042-、 HCO3-
(2) 基于假设4 , 设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
[提示]I、在答题卡上按照下表的方式作答,注意前后内容的对应。
Ⅱ、注意文字简洁,超出答题卡空间视为无效。
III 、可不填满,也可增加步骤。
|
步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
15.(14分)(I)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为: 4Li+2SOCl2 = 4LiCl +S +SO2。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(3)组装该电池必须在无水、无氧的条件下进行,原因是 。
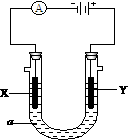
(Ⅱ)电解原理在化学工业中有广泛应用。上图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1).如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X的电极反应式是 (说明:杂质发生的电极反应不必写出)
(2).在上图的基础上,用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为________ mol
14.下列离子方程式正确的是
A. 氢氧化钡溶液中滴加稀硫酸:Ba2++OH-+ H++SO42- ==BaSO4↓+H2O
B.在Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
C. 少量SO2用氨水吸收:2NH3·H2O + SO2 == 2NH4+ + SO32- + H2O
D. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
第Ⅱ卷(非选择题)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com