
题目列表(包括答案和解析)
21.(9分)。
(1) ;
(2) 、 ;
(3) ;
(4) 。 22.(14分)
(1) ;
(2) ;
(3) ;
(4) ;
(5) ,
;
24.(13分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]是浅蓝色晶体,在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
①把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
②在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
③将硫酸亚铁溶液与硫酸铵溶液混合,经过一定的操作得到摩尔盐晶体。
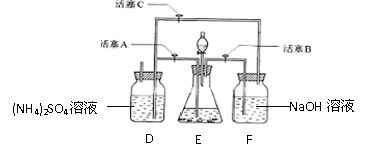
试回答下列问题:
(1)实验步骤①的目的是 ▲ ;实验中替代NaOH溶液的常用试剂是 ▲ ;
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ▲ ,并同时打开活塞 ▲ ;
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用 ▲ ;
(3)下表为硫酸亚铁、硫酸铵、硫酸亚铁铵在水中溶解度(单位:g/100g水)
|
温度(℃) 物质 |
10 |
20 |
30 |
70 |
|
FeSO4 |
20.5 |
26.6 |
33.2 |
56.0 |
|
(NH4)2SO4 |
73.0 |
75.4 |
78.1 |
91.9 |
|
(NH4)2SO4·FeSO4·6H2O |
18.1 |
21.2 |
24.5 |
38.5 |
则步骤③中分离并得到纯净硫酸亚铁铵晶体的操作方法是浓缩结晶、 ▲ 、 ▲ 、干燥。
(4)测定摩尔盐的含量:
制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+。为测定晶体中Fe2+的含量,称取一份质量为20.0 g的硫酸亚铁铵晶体样品,制成溶液。用0.5 mo1.L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO-4被还原成Mn2+时,耗KMnO4溶液体积20.00mL。 滴定时,将KMnO4溶液装在 ▲ (酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 ▲ ;晶体中FeSO4的质量分数为 ▲ 。
衢州一中2009学年度第一学期高三期中试卷
化学答题卷
23.(14分)以惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。
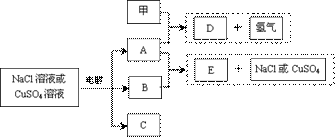
 回答下列问题:
(1)甲元素的原子结构示意图是 ▲ ;
(2)若电解的是NaCl溶液:
①A与B反应的离子方程式是 ▲ ;
②若电解100mL0.02mol•L-1NaCl溶液,阴、阳两极各产生11.2mL气体(标准状况),则所得溶液的pH为 ▲ (忽略反应前后溶液的体积变化)
(3)若电解的是CuSO4溶液:
①E的化学式是 ▲ ;电解时阳极的电极反应式是 ▲ ;
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确是 ▲ ;
回答下列问题:
(1)甲元素的原子结构示意图是 ▲ ;
(2)若电解的是NaCl溶液:
①A与B反应的离子方程式是 ▲ ;
②若电解100mL0.02mol•L-1NaCl溶液,阴、阳两极各产生11.2mL气体(标准状况),则所得溶液的pH为 ▲ (忽略反应前后溶液的体积变化)
(3)若电解的是CuSO4溶液:
①E的化学式是 ▲ ;电解时阳极的电极反应式是 ▲ ;
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确是 ▲ ;
A B C ③工业上为得到高纯度的B,常利用电解法提纯。则在电解时将不纯的B作为 ▲ (填“正极”或“负极”或“阳极”或“阴极”)。
22.(14分)A、B、C、D、E为短周期元素,它们的原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。试回答:
(1)B元素在周期表中的位置为 ▲ ;
(2)将D的单质投入A2C中,反应后得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为 ▲ ;
(3)A、C两元素可组成10电子粒子X-。Y与X-具有相同的原子种类及数目,且不带电,Y的电子式为 ▲ ;
(4)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式 ▲ ;
(5)我国首创的海洋电池以E的单质为负极,铂网为正极,空气做氧化剂,海水做电解质溶液。电池的正极反应式为 ▲ ,电池总反应的化学方程式为 ▲ ;
21. (9分)在773 K、固定体积的容器中,反应CO(g)+2H2(g)
(9分)在773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
(1) 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ▲ ;
(2) 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) ▲
、 ▲ ;
(3) 某温度下,在容积为10L的容器中,若投入1mol CO和3mol H2,平衡时CO的转化率为60%,则反应的平衡常数K为 ▲ ;
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
(1) 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ▲ ;
(2) 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) ▲
、 ▲ ;
(3) 某温度下,在容积为10L的容器中,若投入1mol CO和3mol H2,平衡时CO的转化率为60%,则反应的平衡常数K为 ▲ ;
(4) 下列与催化剂有关的说法中,正确的是 ▲ (填字母序号)。 a.使用催化剂,可以缩短达到平衡需要的时间
b.使用催化剂, 能够提高反应物转化率 c.使用催化剂,不能改变反应的平衡常数K
d.使用催化剂,可使反应CO(g)+2H2(g) CH3OH(g)的ΔH大于-91 kJ·mol-1
CH3OH(g)的ΔH大于-91 kJ·mol-1
20. 用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加0.2mol Cu(OH)2恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为 A.0.8mol B.0.6mol C.0.4mol D.0.2mol
19.我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是(设NA为阿伏加德罗常数) A.该氢氧燃料电池是一种具有应用前景的绿色电源 B.该电池工作一段时间后,电解液中KOH的物质的量不变 C.该氢氧燃料电池工作时氢气在负极被氧化 D.该氢氧燃料电池工作时溶液中阴离子向正极移动
17. 在密闭容器中进行反应2SO2+O2
在密闭容器中进行反应2SO2+O2 2SO3(g)
ΔH<0。右图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是
A.催化剂失效
2SO3(g)
ΔH<0。右图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是
A.催化剂失效
B.减小生成物的浓度 C.降低体系温度
D.增大容器的体积 18. 在一容积可变的密闭容器中,通入1mol X和3 mol Y,在一定条件下发生如下反应:
X (g) + 3 Y (g)  2
Z (g),到达平衡后,Y的转化率为a %,然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b %。则a与b的关系是
A、a=b B、a>b C、a<b D、不能确定
2
Z (g),到达平衡后,Y的转化率为a %,然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b %。则a与b的关系是
A、a=b B、a>b C、a<b D、不能确定
16.已知下列反应的热化学方程式为 (1)C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ.mol-1 (2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3 kJ.mol-1 (3)H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ.mol-1 2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变为 A.+488.3 kJ.mol-1 B.-244.15 kJ.mol-1 C.-488.3 kJ.mol-1 D.+244.15 kJ.mol-1
15.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断不正确的是 A.金属性:Y<Z B氢化物的沸点:X>W C.离子的还原性:X<W D原子及离子半径:Z>Y>X
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com