
题目列表(包括答案和解析)
13、(13分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:
2SO2(g)+O2(g)  2SO3(g) △H=-196.6kJ/mol,2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,回答下列问题:
2SO3(g) △H=-196.6kJ/mol,2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,回答下列问题:
(1)从反应开始至达到化学平衡,生成SO3的平均反应速率为_____________,平衡时SO2的转化率为____________。
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)__________。
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内原子总数不再发生变化 D.混合气体的密度不再发生变化、
E.V正(SO2)=2V逆(O2) F.SO3的生成速率是O2消耗速率的2倍
(3)反应达化学平衡后,以下操作将引起平衡向正反应方向移动,并能提高SO2转化率的是______________。
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氩气(已知氩气和SO2、O2、SO3都不发生反应)
(4)如开始加入2.2 mol SO2和y mol O2,平衡时生成0.6mol SO3,则y = _______。
12、(15分)某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
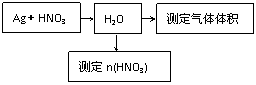

(1)测定硝酸的物质的量
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,消耗NaOH溶液的体积为20.00mL。在B容器中生成硝酸的物质的量为 ____ mol,则Ag与浓硝酸反应过程中生成的NO2体积为 mL。
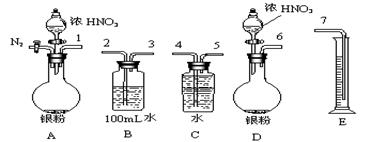
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置
(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的
依据是 。
11、(13分)已知中学常见物质的转化关系如图,A、F为日常生活常见金属单质,C、D为非金属单质,D为黄绿色气体,其余为化合物,G常温下为无色无味液体,回答下列问题:
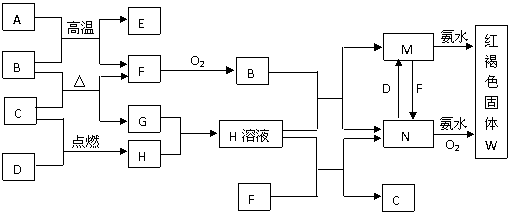
(1)C、D、M的化学式分别为___________、___________、_____________。
(2)写出A和B高温条件下反应的化学方程式_______________________________。
(3)写出下列反应的离子方程式:
M→N:_______________________________________
N→W:________________________________________
(4)A和B的反应属于置换反应,A与其它一些金属氧化物也能发生类似的反应,这类反应在化学上被称为___________反应,写出这类反应的两种用途__________________。
10、(14分)短周期主族元素A、B、C、D、E、F六种元素,原子序数依次增大,A和C同主族,B和E同主族,B和E的原子序数和为A和C原子序数和的2倍,D是地壳中含量最多的金属元素,回答下列问题:(以下各问题均用具体的离子符号或化学式表示)
(1)C、D、E、F形成的简单离子半径由大到小顺序为_____________________。
(2)B、E气态氢化物的稳定性_________>____________。
(3)B、C形成的化合物C2B2所含化学键类型:______________________________。
(4)CA和EF2的电子式分别为___________________,__________________。
(5)F元素在周期表中的位置:________________________________。
(6)E、F最高价含氧酸的酸性:_______________>___________________。
(7)E、F形成简单离子的还原性:____________>____________。
9、一定量Na2O2和NaHCO3固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留固体物质下表中不正确的是:
|
|
Na2O2/mol |
NaHCO3/mol |
残留的固体物质 |
|
A |
1 |
2 |
Na2CO3 |
|
B |
1.5 |
2 |
Na2O2 Na2CO3 |
|
C |
2 |
1 |
Na2O2 NaOH NaHCO3 |
|
D |
2 |
2 |
NaOH Na2CO3 |
第II卷 非选择题(共55分)
8、向分别含SO32-、Fe2+、Br-、I-各0.1mol的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是:
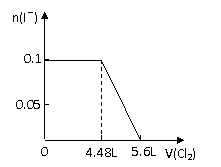
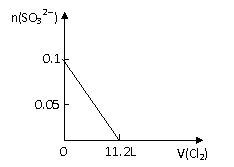
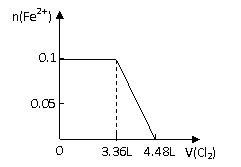
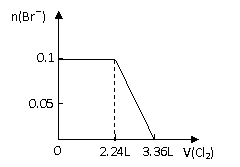 A
B
A
B
C D
7、已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-akJ/mol
②C(s)+O2(g)=CO2(g) △H2=-bkJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H3= -ckJ/mol
则反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为:
A.△H= -(2c+2b-a)kJ/mol B.△H=-(a-2c-2b)kJ/mol
C.△H=-(a+b+c)kJ/mol D.△H=-(2c+2b+a)kJ/mol
6、对下列事实的解释不正确的是:
A.在蔗糖中加入浓硫酸后有刺激性气味气体产生,是由于浓硫酸具有强氧化性
B.浓HNO3在光照下变黄,说明浓HNO3不稳定
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓HNO3在常温下不反应
D.液氨能作制冷剂,是因为液氨汽化时要吸收大量的热,使周围温度急剧降低
5、从矿物学资料查得,一定条件下,自然界中存在如下反应:
14CuSO4+5FeS2+12H2O = 7Cu2S+5FeSO4+12H2SO4
下列说法不正确的是:
A.Cu2S是还原产物
B.产物中的SO42-离子有一部分是氧化产物
C.5molFeS2发生反应,有10mol电子转移
D.FeS2即作氧化剂,又作还原剂
4、下列叙述正确的是:
A.利用丁达尔效应可以区别胶体和溶液
B.硫酸、纯碱、食盐按物质的分类分别属于酸、碱、盐
C.同温、同压、同体积的任何气体具有相同的原子数
D.已知,H2的燃烧热为278kJ/mol,则表示H2燃烧热的热化学方程式为:
2H2(g)+O2(g)=2H2O(l) △H=-556kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com