
题目列表(包括答案和解析)
8. 下列离子方程式正确的是
A.向Mg(HCO3)2溶液中加入过量的NaOH溶液
Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-恰好完全反应
2Ba2++4OH-+Al3++2SO42-=BaSO4↓+AlO2-+2H2O
C.足量的CO2通入饱和碳酸钠溶液中
CO2+CO32-+H2O=2HCO3-
D.向Fe(NO3)2溶液中加入稀盐酸
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
7. 阿伏加德罗常数为NA,下列说法中正确的是
A.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数一定为2NA
B.14g分子式为CnH2n的烯烃中含有的C=C的数目,一定为NA/n
C.71g氯气通入足量水中,反应中转移的电子总数为NA
D.7.5gSiO2晶体中含有的硅氧键数为0.5NA
6. X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
5. 在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Al3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(NH4+)=0.1mol/L的溶液:K+、Ba2+、Cl-、NO3-
D.溶有碳酸氢钠的溶液:K+、SO42-、Cl-、OH-
4.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列说法中错误的是
2CO32-+6H2O,则下列说法中错误的是
A.放电时CH3OH参与反应的电极为负极
B.充电时电解质溶液的pH逐渐减小
C.放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
3. 下列实验操作中,不会发生安全事故的是
A.用无水醋酸钠和碱石灰混合加热制取甲烷,把产生的气体直接点燃,观察燃烧现象
B.用消石灰与NH4Cl固体混合加热,产生的气体用导管直接通入水中制取浓氨水
C.取用少量白磷时,应将白磷没入水中切割,剩余的白磷立即放回原试剂瓶中
D.做完铜与浓硫酸反应实验后的试管,立即用大量水冲洗
2. 下列关于工业生产的说法,错误的是
A.工业上将粗铜进行精炼,应将粗铜连接在电源的正极
B.生产钢化玻璃的主要原料是石灰石、石英和纯碱
C.接触法制硫酸过程中,因为常压下SO2的转化率很高,所以不采用高压
D.合成氨的反应是吸热反应,因此合成氨工业采用高温
1. 2008年北京奥运会开幕式的烟火“脚印”、“笑脸”、“五环”给世界各国留下深刻的印象,其主要原料是黑火药,还有草酸钠、碳酸铜(发出绿色的光)等发色剂和氯酸钾、镁铝粉末等添加剂,据此判断下列说法正确的是
A.碳酸铜因为受热分解才发出绿色的光
B.氯酸钾的主要用途是产生紫色的光
C.烟火颜色的产生与原子核外电子发生跃迁释放能量有关
D.黑火药的主要成分是木炭、硫磺
22.(10分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:SO2+2Fe3++2H2O═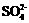 +2Fe2++4H+
+2Fe2++4H+
Cr2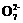 +6Fe2++14H+═2Cr3++6Fe3++7H2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6gFeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式 。
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得
98%在硫酸质量为 t,SO2全部转化为H2SO4时放出的热量是 kJ。
21.(6分)实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平)KClO3+HCl--KCl+Cl2↑+H2O
(1)配平上述反应化学方程式:
KClO3+ HCl-- KCl+ Cl2↑+ H2O
(2)若产生0.1mol Cl2,则转移电子的物质的量为 mol。
(3)若反应中HCl的的利用率只有50%,当氧化产物比还原子能产物多7.1g时,求浓盐
酸的物质的量浓度: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com