
题目列表(包括答案和解析)
21.现代炼锌的方法可分为火法和湿法两大类。
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
焙烧炉中:2ZnS+3O2=2ZnO+2SO2 ①
鼓风炉中:2C+O2=2CO ②
鼓风炉中:ZnO(s)+CO(g) 
 Zn(g)+CO2(g) ③
Zn(g)+CO2(g) ③
⑴请写出反应③的平衡常数表达式 ,若在其它条件不变时,在鼓风炉中增大CO的浓度,平衡将如何移动? ,此时平衡常数 (填“增大”、“减小”或“不变”)。
⑵已知闪锌矿中含硫16%(其它杂质不含硫),则闪锌矿中硫化锌的含量为 。
⑶焙烧炉出来的混合气体中N2占85%,鼓风炉中反应③CO的转化率为80%,为了合理利用资源,防止过量空气的鼓入对生产造成负面影响,请计算每生产l mol Zn,需要向焙烧炉和鼓风炉中鼓入新鲜空气共多少升? (假设矿石中的ZnS全部转化为Zn,反应中的O2均来自于空气,空气中O2与N2的体积比以1:4计算)
高三化学试题第7页,共7页
20.(10分)随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
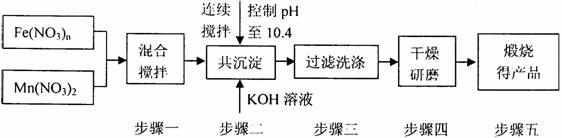
高三化学试题第6页,共7页
⑴原料Fe(NO3)n中n= ,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为 。
⑵步骤二中“连续搅拌”的目的是 ;步骤二中洗涤干净的标准是 。
⑶利用MnFe2O4热化学循环制氢的反应可表示为:

请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为 ;
②该热化学循环制氢的优点有(答两点即可) ;
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是 。
19.(10分)乙醇是日常生活中最常见的有机物之一,乙醇的一种工业制法如下:
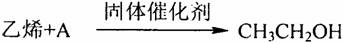
请问答下列问题:
⑴反应物乙烯的电子式为 ;已知该反应中原子利用率为100%,符合绿色化学思想,则反应物A的化学式为 。
⑵工业上还可以用硫酸为吸收剂的间接水合法合成乙醇,从对设备的影响和产品分离角度分析该法与固体催化剂法相比,缺点是 。
⑶乙酸和乙醇在一定条件下可发生反应生成一种有香味的物质,该反应的化学方程式为 ,该反应是可逆反应,请说出提高反应物转化率的一种方法: 。
⑷固体酒精是一种便携的燃料,其一种制备方法是将饱和醋酸钙溶液加入酒精中致使醋酸钙从酒精溶液中析出,呈半固态的凝胶状物质--“胶冻”,酒精充填其中,点燃胶状物时,酒精便燃烧起来。该过程说明醋酸钙在酒精中的溶解度 (填“>”或“<”)醋酸钙在水中的溶解度。
18.(12分)短周期常见元素形成的纯净物A、B、C、D、E转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
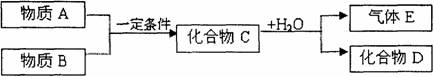
请问答下列问题:
⑴若C是离子化合物,D是一种强碱,写出C的化学式 。
⑵若C与水发生复分解反应,E的水溶液呈现弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用离子方程式解释D既能溶于强酸,又能溶于强碱的原因(仅写出电离方程式即可)。
;
②用等式表示E与NaOH反应生成的正盐溶液中所有离子浓度之间的关系为
;
高三化学试题第5页,共7页
 ⑶若C是一种气体,D是一种强酸,则:
⑶若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
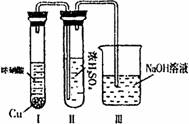
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该 观点是否正确,用右图装置进行实验。实验过程中,浓 H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结 论是 。
③已知常温下物质A与物质B生成1mol气体C的焓变为-57kJ/mol,1 mol气体C与H2O反应生成D溶液和E气体的焓变为-46kJ/mol,写出物质A与物质B及水生成D溶液的热化学方程式 。
17.(12分)铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
高三化学试题第4页,共7页
问题2:CuO在高温下可分解为Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
⑴对于问题1,同学们上网查寻,有两种解释:
A、因为在铁表面上有黑色的铁的氧化物,所以叫黑色金属。
B、因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属。
①你认为正确的说法是 。
②若有一黑色粉末,你如何鉴别是铁粉,还是Fe3O4粉末。
;
③若有一黑色粉末,为铁和四氧化三铁的混合物,你如何证明其中有Fe3O4 (只要求简述实验方法)。 ;
⑵对于问题2,同学们准备实验探究,他们设想了两种方法:
A:将三氧化二铁高温灼烧,看灼烧前后颜色是否变化。
B:将三氧化二铁高温灼烧,看灼烧前后质量是否变化。
①实验中应将Fe2O3放在 (填仪器名称)中灼烧。
②方法A中,如果高温灼烧后颜色由 变为 ,说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗? ,理由是 ;
③方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为 ,但是,实验结果固体灼烧前后质量比为30:29,则高温灼烧后生成物是 ;
④比较两种方法,你认为较好的方法是 。
16.(6分)普通漏斗(见右图)是中学化学实验室常用仪器之一。我们对它的用途并不陌生。
 ⑴请举两例说明普通漏斗在化学实验中的运用:
⑴请举两例说明普通漏斗在化学实验中的运用:
;
⑵你是否探讨过在化学实验中创新地使用普通漏斗?请你积极参与到下面的讨 论中:
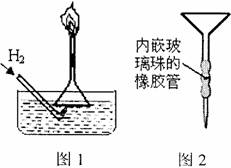 ①右图l是某同学实验室制备H2并验证H2具有可燃
性装置的一部分,请说出他这样做的优点
。
①右图l是某同学实验室制备H2并验证H2具有可燃
性装置的一部分,请说出他这样做的优点
。
②某同学用苯萃取碘水中碘时,找不到分液漏斗。他 灵机一动,先在试管中将混合液充分振荡后静置,然 后再用普通漏斗和其他常见实验仪器和用品组装成-个 简易分液器进行分液(右图2),解了燃眉之急。试分析 该设计的不足之处 。
15. (12分)右图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。回答下列问题:
(12分)右图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。回答下列问题:
⑴请在右图中将过渡元素所在的位置涂黑。
⑵工业上冶炼M的化学方程式为 。
⑶M和R组成化合物MR的超细粉末被广泛应用 于大规模集成电路生产等领域。其制取原理是用 M的氧化物、R的单质与碳单质在高温下反应,已知反应中三种物质的物质的量之比为 1:1:3,该反应的化学方程式为 ,反应中 作氧化剂。
⑷图中A、B两元素形成的离子B2A82-中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8 电子结构。该离子可能具有的化学性质是 ,依据是 。
14.某现代化的自动酸度测定仪有自动校正温度的功能,能把不同温度下测得的pH自动校正为常温下的数据,下列说法正确的是
A.用该仪器测定碳酸饮料,pH小于7
B.无论什么温度,该仪器测定HAc与NaAc的混合溶液,pH一定小于7
C.用该仪器测定某溶液pH等于6,该溶液在原温度下pH一定大于6
D.在80℃时,测定某溶液pH=7,若不校正,pH应小于7
高三化学试题第3页,共7页 第Ⅱ卷(非选择题 共72分)
13. 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容
器中发生反应。反应过程中H2、N2和NH3物质的量变化如
右图所示,下列说法正确的是
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容
器中发生反应。反应过程中H2、N2和NH3物质的量变化如
右图所示,下列说法正确的是
A.反应开始到第一次平衡时,N2的平均反应速率为 0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10 min至20 min时可 能是使用了催化剂
C.从曲线变化可以看出,反应进行至25 min时,分离出 0.1 mol的氨气
D.在25 min时平衡正向移动,但达到新平衡后NH3的体积分数比原平衡小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com