
题目列表(包括答案和解析)
4、某溶液中有Ca2+、NH4+、Mg2+、Fe2+和Al3+五种离子,若向其中加入过量的氢氧化钠溶液微热并搅拌, 再加入过量盐酸,溶液中的阳离子基本不减少的是 ( )
A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
3、下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是 ( )
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.NaAlO2 和H2SO4 D.Ba(HCO3)2和Ba(OH)2
2、将KCl和CrCl3两种固体混合物共熔,得化合物X。X由K、Cr、Cl三种元素组成。将1.892gX中的铬元素全部氧化成Cr2O72-,后者可以从过量的KI溶液中氧化出2.667g碘单质(Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O)。如果取溶有1.892gX的溶液加入过量AgNO溶液,可得到4.52gAgCl沉淀。则X的化学式为 ( )
A.K3Cr2Cl7 B.K3Cr2Cl5 C.K3Cr2Cl9 D.K3CrCl4
1、下列反应中,属于非氧化还原反应的是 ( )
A.3CuS+8HNO3 3Cu(NO3)2+2NO↑+3S↓+4H2O B.3Cl2+6KOH
3Cu(NO3)2+2NO↑+3S↓+4H2O B.3Cl2+6KOH 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
C.3H2O2+2KCrO2+2KOH 2K2CrO4+4H2O
D.3CCl4+K2Cr2O7
2K2CrO4+4H2O
D.3CCl4+K2Cr2O7 2CrO2Cl2+3COCl2+2KCl
2CrO2Cl2+3COCl2+2KCl
12.化合物A含硫(每个分子只含一个硫原子)、氧以及一种卤素。少量A与水反应完全水解但不发生氧化还原反应,所有反应产物均可溶于水。将A配成水溶液稀释后分成几份,分别加入一系列0.1mol/L的试剂,现象如下:
①加入硝酸酸化的硝酸银,产生白色沉淀;
②加入氯化钡溶液,无沉淀产生;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀。
(1)由此判断组成该化合物的元素中,可能存在的卤素是 ,A与水反应后生成的溶液中硫元素的主要化合价为 。
(2)A溶于水所得溶液呈 (填“酸性”、“中性”、“碱性”),在该溶液中通入少量Cl2的化学方程式为 。
(3)为了确定该化合物的分子式,称取11.90gA溶于水稀释至250.00mL,取25.00mL溶液加入足量的高锰酸钾和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重为2.33g。则A的化学式为 。
11.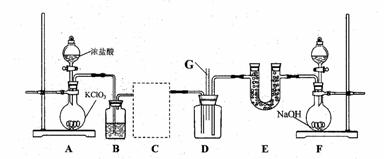 干燥纯净的氯气与氨气反应除得到氮气外,还有另一种产物。某研究小组在探究该产物时设计了如下实验:
干燥纯净的氯气与氨气反应除得到氮气外,还有另一种产物。某研究小组在探究该产物时设计了如下实验:
实验中观察到D装置中先出现浓厚的白烟,后在内壁凝结成白色固体。请回答下列问题:
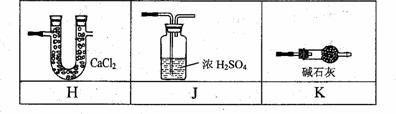
(1)为达到实验目的,E装置中的试剂是 (填试剂名称),C装置可选用下表中的 装置(填字母编号);
(2)为使实验顺利进行,请简述A、F中的分液漏斗的正确操作方法
。
(3)装置A中发生反应的化学方程式 ;当反应过程中转移5mole-,则生成的气体在标准状况下的体积约是 L;
(4)将装置D中生成的白色固体取出,并与适量熟石灰充分混合加热,得到一种能使湿润的红色石蕊试纸变蓝的气体。写出该反应的化学方程式 。
(5)装置D中发生反应的化学方程式是 。
10.NH4NO3在不同条件(温度)下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应
⑴若NH4NO3在通常条件下加热的分解产物不出下列范围,根据已学知识(化合价升降规律等)判断,下列反应可能的是 (有错选得“0”分)
A、NH4NO3→N2+O2+H2O B、NH4NO3→NH3+HNO3
C、NH4NO3→O2+HNO3+H2O D、NH4NO3→N2+HNO3+H2O
E、NH4NO3→N2+NH3+H2O F、NH4NO3→N2O+H2O
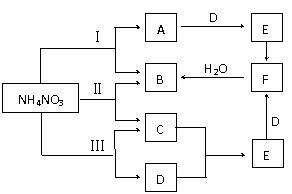 ⑵现将NH4NO3晶体在三种不同温度下加热使其分解,若分解产物能发生如图所示的转化关系(仅反应条件及反应Ⅱ、Ⅲ两个反应中生成的水被略去)
⑵现将NH4NO3晶体在三种不同温度下加热使其分解,若分解产物能发生如图所示的转化关系(仅反应条件及反应Ⅱ、Ⅲ两个反应中生成的水被略去)
回答下列问题
写出下列物质的分子式
A、 E、 F、
②请写出反应Ⅲ的化学方程式
Ⅲ、
9.焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是 (写化学式)。
(2)写出并配平该反应的化学方程式,并标出电子转移的方向和数目:
(3)发生氧化反应的物质是 ,反应中4mol的氧化剂能 (填“失去”或“得到”) mol电子.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为 g。
8.一定质量的A1、Mg合金与适量的稀硫酸恰好完全反应,将反应后的溶液蒸干,所得固体(不含结晶水)质量比原固体增加了4.8g,则该合金的物质的量可能为
A.0.04mol B.0.05mol C.0.06mol D.0.07mol
7.把一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6L(在标准状况下.)。将反应后的溶液稀释到1 L,测得溶液的pH=1,则下列叙述正确的是
A.反应中共生成硫酸锌2mol B.气体Y中SO2和H2的体积比为4:1
C.反应中共消耗锌97.5g D.反应中共转移电子4 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com