
题目列表(包括答案和解析)
15、CxHyOz是某一类有机化合物的通式,其相对分子质量为136,碳的质量分数是氧的质量分数的3倍。
(1)这一类有机化合物CxHyOz的化学式为 。
(2)若该有机化合物CxHyOz属于酯类且分子中含有苯环,则其可能的同分异构体有多种。在这些同分异构体中,若水解后得到一种羧酸和一种醇,则它的结构简式可能为 、 ;若水解后得到一种羧酸和一种酚,则它的可能结构共有 种。
(3)若该有机化合物CxHyOz不能使FeCl3溶液显色,但可被新制的银氨溶液氧化为A,lmolA跟足量金属钠反应,能生成0.5molH2。
①1molCxHyOz最多能与 molH2反应。
②请写出任意一种符合上述条件的CxHyOz与醋酸反应的化学方程式 。
江苏省东台市五烈镇中学2010届高三化学周练
14、已知:氧化性KMnO4>HNO3,KMnO4在酸性条件下被还原生成Mn2+,硫酸铅是不溶于水和强酸的白色沉淀;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2酸性溶液依次进行下列实验,现象记录如下:
①滴加一定量的NaBiO3溶液,溶液变为紫红色。
②继续滴加一定量的H2O2,紫红色褪去,并有气泡产生。
③再加入一定量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体。请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为___________________________。
(2)实验②③反应的离子方程式分别为____________________、__________________________。
(3)实验④中的现象为____________________________________________。
13、完成并配平下列化学方程式:
⑴ KMnO4+ KNO2+ 
 MnSO4+
K2SO4+
KNO3+ H2O
MnSO4+
K2SO4+
KNO3+ H2O
⑵ Na2CrO4+ Na2S+ H2O Cr(OH)3+ Na2SO4+
Cr(OH)3+ Na2SO4+ 
12、羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原,现用25.00mL0.049mol·L-1羟胺的酸性溶液与足量硫酸铁溶液反应,生成的Fe2+恰好与24.50mL0.020 mol·L-1KMnO4酸性溶液完全作用:2KMnO4 + 10FeSO4 + 8H2SO4 = 5Fe(SO4)3 + K2SO4 + 8H2O + 2MnSO4,则上述反应中羟胺的氧化产物为
A.N2 B.N2O C.NO D.NO2 ( )
11、设NA为阿伏加德罗常数的数值,下列有关说法中正确的是 ( )
A.3 mol铁与足量的水蒸气充分反应,转移8NA个电子
B足量的铜与含2 mol H2SO4的浓硫酸充分反应,可生成NA个SO2分子
C 200mL 5mol·L-1Na2CO3的溶液中,含NA个CO32-
D 78 g过氧化钠晶体中含有2NA个阴离子
10、下列离子方程式书写正确的是 ( )
A.C12通入Na2S03溶液:2C12+H20+S032-=2HCl+S02↑+2Cl-
B.氯化铝溶液中加入过量氨水:Al3++3NH3·H20=Al(OH)3↓+3NH4+
C.水杨酸(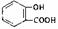 )中加入Na2C03溶液:
)中加入Na2C03溶液: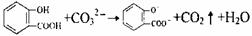
D.S02通入酸性高锰酸钾溶液:5S02+2Mn04-+2H20=2Mn2++5S042-+4H+
8、向100 mL FeBr2 溶液中通入标准状况下的 Cl2 3.36 L 全部被还原,测得溶液中c(Br-)= c(Cl-) ,则原 FeBr2 溶液的物质的量浓度是 ( )
A.0.75 mol/L B.1.5 mol/L C.2 mol/L D.3 mol/L
9、在下列溶液中,各组离子一定能够大量共存的是 ( )
A.含有大量I-的溶液:H+、Fe3+、Cl-、N03-
B.加入铝粉能放出大量H2的溶液:K+、NH4+、S042-、HC03-
C.常温下pH=7的溶液:Fe3+、Na+、Cl-、N03-
D.常温下c(OH-)/c(H+)=1012的溶液:K+、Ba2+、Cl-、Br-
7、G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):①G→Q+NaCl ②Q+H2O→X+H2 ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序是 ( )
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
6、含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
( )
A.x=0.4a,2Fe2-+Cl2=2Fe3++2Cl- B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
5、常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+H+下列说法正确的是 ( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变 D.H2O2生产过程要严格避免混入Fe2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com