
题目列表(包括答案和解析)
8.燃料电池是燃料(例如CO,H2,CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质通常是KOH溶液。下列关于甲烷燃料电池的说法不正确的是
A.负极反应式为CH4+10OH--8e=CO32-+7H2O
B.正极反应式为O2+2H2O+4e=4OH-
C.随着不断放电,电解质溶液碱性不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
7.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1L 1mol·L-1的两种强酸溶液中,所含氢离子数目均为NA
B.T ℃时,1 L pH=6纯水中,含10-6NA个
C.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
D.标准状况下22.4LHCl气体溶于水,其溶液中H+数为NA
6.下列各组离子在指定环境中一定能大量共存的是
A.在碳酸氢钠溶液中: K+、Al3+、SO42-、Cl-
B.存在较多Fe3+的溶液中:Na+、SCN-、CO32-、K+
C.常温下由水电离出的C(H+)水·C(OH-)水 = 10-24 溶液中:NH4+、Cl-、CO32-、F-
D.在能使pH试纸变深蓝色的溶液中:Na+ 、S2- 、CO32-、NO3-
5.下列溶液中有关微粒的物质的量浓度的比较正确的是
A.常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液 c(H+):①<②
B.常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中:
c(Na+)= c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-)
C.相同条件下,pH=9的①CH3COONa溶液、②NH3·H2O溶液、③NaOH溶液中由水电离出的
c(OH-):①>②>③
D.已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:
[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)]
4.下列实验事实不能证明醋酸是弱酸的是
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,测得0.1mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
3.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |

 下列说法错误的是:
下列说法错误的是:
 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50%
 B.上述反应为X+3Y
B.上述反应为X+3Y  2Z
,其平衡常数为1600
2Z
,其平衡常数为1600
 C.增大压强使平衡向生成Z的方向移动,平衡常数不变
C.增大压强使平衡向生成Z的方向移动,平衡常数不变
 D.若改变温度反应的平衡常数变大,则一定为升高温度
D.若改变温度反应的平衡常数变大,则一定为升高温度
2. 反应3Fe(s)+4H2O(g)  Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
A.容器内压强不再改变
B. (H2O)=
(H2O)= (H2)
(H2)
C.气体的密度不再改变 D.反应不再进行
1.有关下列各组热化学方程式中关系说法正确的是
2H2(g)+O2(g)=2H2O(g); △H1 = -Q1kJ/mol
2H2(g)+O2(g)=2H2O(1); △H2 = -Q2kJ/mol
H2(g)+1/2O2(g)=H2O(1);△H3 = -Q3kJ/mol
A.△H1=△H2 B.△H1<△H2 C. Q1 >2Q3 D.△H1>2△H3
19.(11分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
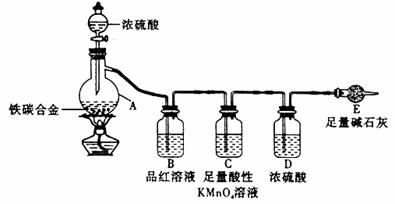
Ⅰ 探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为________。
未点燃酒精灯前,A、B均无明显现象,其原因是:____ _。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式_____________________________________(只写一个)。B中的现象是______________,由此可得到浓硫酸具有____________性。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式________________________________(只写一个)。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式)。
 (7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是_________________(填写代号)。
(7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是_________________(填写代号)。
A. 用排水法测定H2的体积
B. 反应结束后,过滤、洗涤、干燥、称量残渣的质量
C. 测定反应前后装置和药品的总质量。
安徽省萧城一中2010届高三周练化学试题(二)
18.(14分)W、X、Z足原子序数依次增大的同一短周期元素,W、X是舍属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为___________________________。
(3)X的硝酸盐水溶液显_________性,用离子方程式解释原因: __________________________________________________________________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为__________________________________________________________________________。
(5)比较Y、Z气态氢化物的稳定性:____________ >____________(用分子式表示)。
(6)W、X、Y、Z因种元素简单离子的离子半径由大到小的顺序是
_____________ > ___________ > ___________ > ______________。 (7)Z的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并
放出Q kJ 的热量。写出该反应的热化学方程式________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com