
题目列表(包括答案和解析)
18.(共11分)(1)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ki = 1.75×10-5
碳酸 Ki 1= 4.30×10-7 Ki 2 = 5.61×10-11
亚硫酸 Ki 1= 1.54×10-2 Ki 2 = 1.02×10-7
① 写出碳酸的第一级电离平衡常数表达式:Ki = _________________
② 在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:_____>_____>_____
③ 若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)
A. c(CH3COO-) B. c(H+) C.醋酸电离平衡常数 D. 醋酸的电离度
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积。在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知有关物质的颜色和溶度积如下:
|
物质 |
AgCl |
AgI |
Ag2S |
|
颜色 |
白 |
黄 |
黑 |
|
KSP(25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KCl溶液,则无白色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
17. (8分)如图所示,温度不变下某容器分隔成A、B两部分,A容器固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2 molSO3和1molN2,在相同条件下发生可逆反应:
(8分)如图所示,温度不变下某容器分隔成A、B两部分,A容器固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2 molSO3和1molN2,在相同条件下发生可逆反应:
2SO2(g)+O2(g) 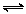 2SO3(g),根据下列要求填空:
2SO3(g),根据下列要求填空:
(1)固定活塞位置在3处不动,达到平衡后,设A中压强为PA,B中压强为PB,则PA与PB的压强是PA PB (填“<”、“>”、“=”)。
(2)若要使A中与B中平衡状态相同,可移动活塞的位置应固定在 处。
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x y的(填“<”、“>”、“=”),理由是 。
16.(14分)现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
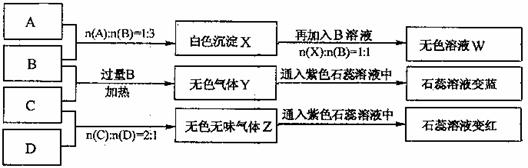
(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为 、 。
(2)D溶液pH (填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)
。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4):前者 后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序
是
15. (8分)(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32-水解所至。请你设计一个简单的实验方案给甲和乙两位
同学的说法以评判(包括操作、现象和结论)
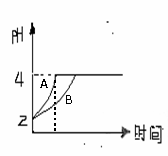 (2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化
曲线的是 (填“A”或“B”)。
设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。
则m1 m2(选填“<”、“=”、“>”)
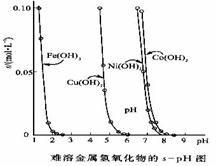
14.右图表示难溶氢氧化物在不同pH下的溶解度
(s,mol·L -1),下列说法中正确的是
A.pH=4时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶
液pH的方法来除去
C.若分离Cu2+溶液中的Fe3+,可调节溶液的pH在4左右
D.在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
Ⅱ卷(非选择题 共52分)
13.T°C时,将体积为VAL、浓度为a mol/L的一元酸HA与体积为VBL、浓度为b mol/L
的一元碱BOH混合,混合液恰好呈中性,则下列判断正确的是
 A.混合液的pH=7 B.a=b
A.混合液的pH=7 B.a=b
C.混合液中Kw=[c(H+)]2 D.a=b,VA=VB
12.下面是一段关于中和滴定实验操作的叙述:①取一锥形瓶,用待测NaOH溶液润洗两次。②在一锥形瓶中加入25 mL待测NaOH溶液。③加入几滴石蕊试剂做指示剂。④取一支酸式滴定管,洗涤干净。⑤直接往酸式滴定管中注入标准酸溶液,进行滴定。⑥左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶。⑦两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点。文中所述操作有错误的序号为
A.④⑥⑦ B.①⑤⑥⑦ C.③⑤⑦ D.①③⑤⑦
11.在amL浓度为c mol·L-1的AgNO3溶液中加入一定体积的pH=1的盐酸时,恰好使溶液中Ag+完全沉淀,此时得到pH=2的溶液100 mL(设反应前后溶液体积变化忽略不计),则c的值是

A.0.0020 B.0.011 C.0.11 D.0.22
10.由可逆反应绘出图像如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是
A.反应物中一定有气体 B.生成物中一定有气体
C.正反应一定是放热反应 D.正反应一定是吸热反应
9.一定温度下,取0.2 mol/L HX溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化,下同)得溶液甲;另取0.2 mol/L HX溶液与0.1 mol/L NaOH溶液等体积混合得溶液乙。测得溶液甲的pH=8,溶液乙的pH>7。下列结论错误的是
A.甲溶液中由水电离出的c(OH¯) > 0.2 mol/L HX溶液中由水电离出的c(H+)
B.甲溶液中c(Na+) - c(X-)=1.0×10−8 mol/L
C.甲溶液中c(OH-) - c(HX) =1.0×10−8 mol/L
 D.溶液乙中, c(HX)>c(Na+)>c(X-)>c(OH-)> c(H+)
D.溶液乙中, c(HX)>c(Na+)>c(X-)>c(OH-)> c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com