
题目列表(包括答案和解析)
10.哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3 mol H2,在一定条件下发生反应:N2(g) + 3H2(g) 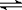 2NH3(g)
, 正反应为放热反应,并达到平衡。欲使c(NH3)/c(H2)的比值增大,下列不应采取的措施是
2NH3(g)
, 正反应为放热反应,并达到平衡。欲使c(NH3)/c(H2)的比值增大,下列不应采取的措施是
A.温度不变,增大体系的压强 B.体积、温度不变,增加H2的物质的量
C.体积、温度不变,增加N2的物质的量D.体积不变,降低体系的温度
9. 在一密闭容器中使1LNO2 分解生成 NO和 O2 ,达到平衡时,气体的总体积变为1.2L,则下列说法正确的是
A.NO2的分解率为60%
B.达到平衡时, NO2、N O 、O2的物质的量之比是3:3:1
C.NO2的分解率为40%
D.达到平衡时, NO2、N O、O2的质量之比是3:2:1
8.在一定温度下,可逆反应A2(g) + B2(g)
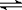 2AB (g)达到平衡的标志是
2AB (g)达到平衡的标志是
A.容器内的总压强不随时间变化
B.单位时间内生成2n molAB的同时生成n mol B 2
C.单位时间内生成n mol A2的同时生成n molAB
D.条件一定,混合气体的平均相对分子质量不再变化
7.下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1
C(s)+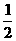 O2(g)
O2(g) CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g) SO2(g);△H4
③H2(g)+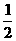 O2(g)=H2O(l);△H5 2H2(g)+O2(g)
O2(g)=H2O(l);△H5 2H2(g)+O2(g) 2H2O(l);△H6
④CaCO3(s) CaO(s)+CO2(g);△H7 CaO(s)+H2O(l) Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
6.已知一定温度下,2X(g)+Y(g)  mz(g);ΔH =-a kJ·mol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入2 mol X和1 mol Y,达到 平衡状态时,放出热量b kJ,向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值成关系正确的( )
mz(g);ΔH =-a kJ·mol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入2 mol X和1 mol Y,达到 平衡状态时,放出热量b kJ,向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值成关系正确的( )
A.m=4 B.a=b C.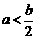 D.m≤2
D.m≤2
5.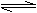 向甲乙两个容积均为lL的恒容容器中,分别充人2mol A、2m0I B和l mol A、l mol B。相同条件下,发生下列反应:A(g)+B(g) xC(g):△H<0。测得两容器中c(A)随时间t的变化如图所示:
向甲乙两个容积均为lL的恒容容器中,分别充人2mol A、2m0I B和l mol A、l mol B。相同条件下,发生下列反应:A(g)+B(g) xC(g):△H<0。测得两容器中c(A)随时间t的变化如图所示:
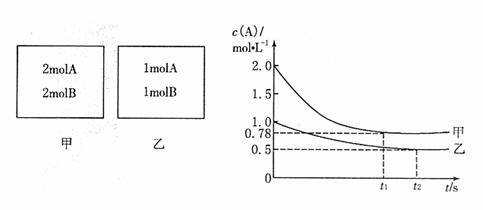
则以下说法正确的是
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充人氦气可使c(A)增大
C.将乙容器升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充人2mol A、2mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
4.根据相应的图像(图像编号与答案一一对应),判断下列相关说法正确的是
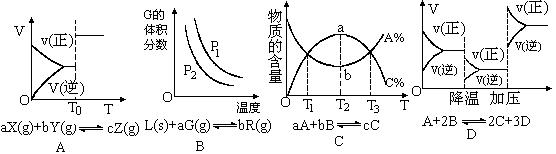
A.密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
C.物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应
D.反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体
2.在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
2A(g) + B(g)  3C(g)
+ D(s),达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是
3C(g)
+ D(s),达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是
A.1mol A+0.5mol B+1.5mol C+0.1mol D B.3mol C+ 1mol D
C.4mol A+2mol B D.0.5mol A+0.25mol B+2.25mol C
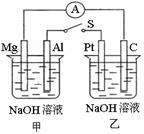 3.如右图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合
3.如右图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合
开关S后,以下表述正确的是
A.电流表指针不发生偏转
B.Al、Pt两极有H2产生
C.Mg、C两极生成的气体可以恰好完全反应
D.甲池pH减小,乙池pH不变
1.一定量的某混合气体在密闭容器中发生如下反应:
m A(g) + n B(g)  PC(g),当反应达到平衡时,测得B的浓度为1 mol·L-1;若将平衡气体的体积缩小到原来的1/2,重新达到平衡时,B的浓度为1.8
mol·L-1(温度保持不变)。下列判断可能正确的是
PC(g),当反应达到平衡时,测得B的浓度为1 mol·L-1;若将平衡气体的体积缩小到原来的1/2,重新达到平衡时,B的浓度为1.8
mol·L-1(温度保持不变)。下列判断可能正确的是
A.m=1,n=2,p=3 B.m=1,n=3,p=2
C.m=1,n=1,p=3 D.m=2,n=1,p=4
19.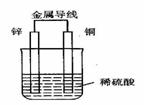 (1)右图是铜锌原电池,某同学做完实验后记录如下:
(1)右图是铜锌原电池,某同学做完实验后记录如下:
①Zn为正极,Cu为负极 ②电解质溶液pH不变 ③电子流动的方向为:Zn→Cu ④Cu极上有氢气产生 ⑤若有1mol电子流过导线,则产生氢气0.5 mol ⑥该原电池产生氢气的速度比没有导线相连时慢
上述记录中描述正确的是
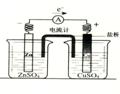 (2)有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)
(2)有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)
A.反应中,盐桥中的K+会移向CuSO4溶液
B.取出盐桥后,电流计依然发生偏转
C.铜片上有气泡逸出
D.反应前后铜片质量不改变
(3)2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
A.左边为该电池的负极 B.该电池可在高温环境下使用
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为:O2+4e-=2O2-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com