
题目列表(包括答案和解析)
20.(15分)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)  2SO3(g) ;△H<0
2SO3(g) ;△H<0
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(2)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3的物质的量
(3)下列是某研究机构的研究成果
硫酸工业的原料气是二氧化硫、氧气及大量的氮气,根据下列两幅图表,解读正确的选项是________(填写字母序号)
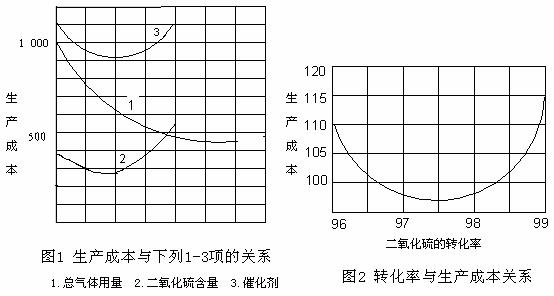
A.SO2浓度高大,生产工艺复杂,生产成本反而会增加
B.生成规模大,气体用量多,生产成本就越低
C.SO2转化率越大,生产成本越低
D.适量加入催化剂,可大大提高SO2的转化率
II.水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。己知:
C
(s) + H2O(g)  CO (g) +H2 (g);△H
=+131.3kJ•mol-1
CO (g) +H2 (g);△H
=+131.3kJ•mol-1
C (s) + O2(g)=CO (g);△H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l);△H = -285.8kJ·mo1-1
(1)由CO、H2在一定条件下可获得汽油的替代品--甲醇,甲醇的燃烧热为-726.5 kJ/mol,试写出由CO、H2生成甲醇的热化学方程式 _______________________ 。
(2)甲醇-NaOH溶液-空气燃料电池已广泛的应用,试写出其负的电极反应式 。
安徽省萧城一中2010届高三周练化学试题(一)
19.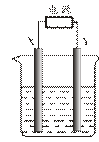 (18分)某化学兴趣小组用图示装置进行电解原理的实验探究。
(18分)某化学兴趣小组用图示装置进行电解原理的实验探究。
(1)X、Y均用石墨作电极,电解质溶液为500 mL CuSO4溶液,电解一段时间,观察到X电极表面有红色的固态物质生成。当电解质溶液中的Cu2+ 全部析出时断开电源,Y电极有280 mL(标准状况)无色气体生成(假设电解前后溶液体积不变)。
① X与电源的 极相连,写出电解总反应的离子方程式: ;② 电解后溶液的pH= ;③ 要使电解后溶液恢复到电解前的状态,需加入一定量的 (填加入物质的化学式)。
(2)用该装置精炼粗铜,电解质溶液仍为CuSO4溶液。① 与电源正极相连的X电极是用 制成的;② 粗铜中含有Zn、Fe、Ni、Ag、Au等杂质,其中有些杂质会在电极上放电,列举其中一个电极反应式: ,阳极泥的主要成分是 。
(3)X、Y均用铜作电极,电解质溶液为 NaOH溶液,电解一段时间,同学们惊奇地发现,阳极附近不是生成蓝色沉淀,而是生成红色沉淀,经过查阅资料,得知该红色沉淀是Cu2O。写出阳极上的电极反应式: ,电解总反应的化学方程式为 。
18.(12分)在2 L密闭容器中加入2 mol A和1 mol B,发生如下反应:
2A(g)+B(g) 4C(g)+D(?)
4C(g)+D(?)
4 min时达到平衡,C的浓度为0.4 mol/L,D的物质的量为0.2 mol。
(1)4 min内,用B物质表示的平均反应速率为 ,A的转化率为 。
(2)若D是气体,升高温度后,混合气体的平均相对分子质量增大,则该反应的正反应是 反应。(填“放热”、“吸热”)
(3)保持温度和体积不变,向平衡混合物中再加入2 mol A、1 mol B,达到新平衡后C的浓度 0.8 mol/L(填“>”、“<”、“=”)。
(4)若D是固体,按不同配比加入起始物质,达到平衡时,C的浓度仍是0.4 mol/L。
①如果从逆反应方向建立平衡,D的起始物质的量应满足的条件是 。
②如果加入0.2 mol A、0.1 mol B,则C和D起始物质的量分别应满足 。
17.(14分)A、B、C、D、E五种短周期元素,原子序数依次递增。A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大,E与C是同主族元素。C、D两种元素可形成化合物甲,甲中既有离子键又有共价键;A、B、C、D四种元素可形成化合物乙,乙放入水中所得溶液显碱性。请回答:
(1)化合物甲的电子式为 ;乙的化学式有很多种,其中无机物是 ,相对分子质量最小的有机物是 。
(2)气体A2、C2和A、C、D形成的离子化合物的水溶液可形成燃料电池,其正极的电极反应式为 ,电池总反应得到1.8 g产物时,流经外电路某一横截面的电子数为 。
(3)A、B能形成无数种化合物,其中密度最小的气态化合物燃烧热为890.3 kJ/mol,则该化合物燃烧的热化学方程式为 。
(4)都由A、C、D、E形成的两种化合物可以相互反应,其离子方程式为 。
16.(6分)已知氯水中有如下平衡:CI2 + H2O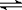 HCI +HCIO 。常温下在一个容积为50 ml针筒(针筒内的活塞可自由滑动)中吸入40mlCI2和10mlH2O,若将此针筒长时间放置在有日光的地方,最终观察到的现象是气体体积减小,气体和溶液均变成无色。试用化学平衡的观点解释此现象
;用化学平衡的观点解释排饱和食盐水可收集氯气的原因 。
HCI +HCIO 。常温下在一个容积为50 ml针筒(针筒内的活塞可自由滑动)中吸入40mlCI2和10mlH2O,若将此针筒长时间放置在有日光的地方,最终观察到的现象是气体体积减小,气体和溶液均变成无色。试用化学平衡的观点解释此现象
;用化学平衡的观点解释排饱和食盐水可收集氯气的原因 。
15. 如图所示,反应:X(g)+ 3Y(g)
如图所示,反应:X(g)+ 3Y(g) 2Z(g) ,正反应为放热反应,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
2Z(g) ,正反应为放热反应,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
14.在一定条件下,测得2CO2 2CO+O2平衡体系的平均相对分子质量为M 。在此条件下,CO2的分解率是
2CO+O2平衡体系的平均相对分子质量为M 。在此条件下,CO2的分解率是
A.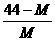 B.
B. 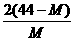
C. 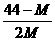 D.
D. 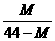
13.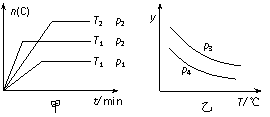 在一容积可变的密闭容器中发生反应:A(g)+B(g)
在一容积可变的密闭容器中发生反应:A(g)+B(g) xC(g),生成物C的物质的量随反应时间的变化关系如图甲所示,由此可知,关于图乙的分析判断正确的是
xC(g),生成物C的物质的量随反应时间的变化关系如图甲所示,由此可知,关于图乙的分析判断正确的是
A.p3>p4,y轴表示A的转化率
B.p3>p4,y轴表示B的体积分数
C.p3<p4,y轴表示C的体积分数
D.p3<p4,y轴表示混合气体的平均相对分子质量
12.现有下列四个图像:
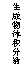
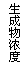
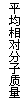
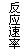
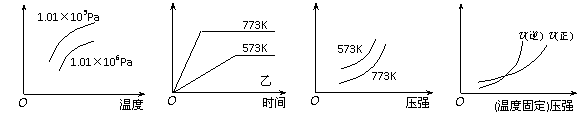
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g) 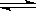 2NH3(g);△H=-Q1kJ/mol(Q1>0)
2NH3(g);△H=-Q1kJ/mol(Q1>0)
B.2SO3(g)
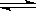 2SO2(g)+O2(g);△H=+Q2
kJ/mol(Q2>0)
2SO2(g)+O2(g);△H=+Q2
kJ/mol(Q2>0)
C.4NH3(g)+5O2(g) 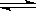 4NO+6H2O(g);△H=-808.7 kJ/mol
4NO+6H2O(g);△H=-808.7 kJ/mol
D.H2(g)+
CO(g)  C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0)
C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0)
11. 在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应:
2A(g) + B(g)  C(g) + D(g) ,达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
C(g) + D(g) ,达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
A. 4 mol A +2 mol B B.2 mol A +1mol B +3mol C +1mol D
C. 3mol C +1mol D D. 3mol C +1mol D +1molB
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com