
题目列表(包括答案和解析)
20、(12分) 重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等。以铬铁矿(主要成分为Cr2O3还含有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:
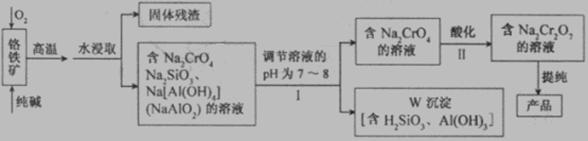 请回答下列问题。
(1)若I中只用一种试剂调节溶液的pH,应选用___________(填标号)。
A.稀硫酸
B.氧化钠固体
C.氢氧化钾溶液
(2)I中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是
_______________________________________________________
(用离子方程式表示)。
(3)Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下: 2CrO42- (黄色)+2H+
请回答下列问题。
(1)若I中只用一种试剂调节溶液的pH,应选用___________(填标号)。
A.稀硫酸
B.氧化钠固体
C.氢氧化钾溶液
(2)I中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是
_______________________________________________________
(用离子方程式表示)。
(3)Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下: 2CrO42- (黄色)+2H+ Cr2O72-
(橙红色)+H2O
①该反应________氧化还原反应(填“是”或“不是”),反应的平衡常数表达式 K=__________。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液_______ (填标号)。
A.变黄色
B.颜色不变 C.橙红色变深
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃时,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是_____________________。
Cr2O72-
(橙红色)+H2O
①该反应________氧化还原反应(填“是”或“不是”),反应的平衡常数表达式 K=__________。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液_______ (填标号)。
A.变黄色
B.颜色不变 C.橙红色变深
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃时,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是_____________________。
19、(10分)A、B、C、X均为中学化学常见的物质,它们之间有如下转化关系(副产物已略去)。
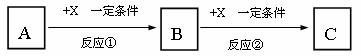 试回答:
试回答:
⑴ 若X是强氧化性单质,则A不可能是_______________。
a.S b.N2 c.Na d.Mg e.Al
⑵ 若A为强碱溶液,则X可能为________________。
a.AlCl3 b.CO2 c.Al d.Mg e.Al2O3
⑶ 若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________;C溶液在贮存时应加入少量X,理由是(离子方程式表示) 。
⑷ 若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液能反应生成B,写出该反应的离子方程式 。
18、(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为
。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与t的关系如下表:
2NH3(g),其化学平衡常数K与t的关系如下表:
|
t/K |
298 |
398 |
498 |
…… |
|
K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题: ①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。 A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)= v(H2)(逆) C.容器内压强保持不变 D.混合气体的密度保持不变 (3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。 ①写出盐酸肼第一步水解反应的离子方程式 。 ②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。 A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-) B.c(Cl-)>c([N2H5·H2O]+)>c(OH-)>c(H+) C.2c(N2H62+)+c([N2H5·H2O]+)+ c(H+) = c(Cl-)+c(OH-) D.c(N2H62+) > c(Cl-)> c(H+) >c(OH-)
17、(12分)I、(1)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵,则①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。 (2)已知某温度下,纯水中的C(H+)=5×10-7mol/L,则此时溶液的C(OH-)为 mol/L;若温度不变,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
II、在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(g)+2B(g) 2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
⑴若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是 热反应。
⑵欲使反应维持向逆反应方向移动,则x的取值范围为 。
 ⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(g)+E(g)
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(g)+E(g) 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用
m、n表示;设A、B、C和D、E、F之间均不发生反应)。
16、常温下,下列各组数据中比值为2:1的是:
A.电解熔融氯化钠,在阴极和阳极上析出产物的物质的量之比 B.中和体积相同、pH相同的硫酸和盐酸消耗NaOH的物质的量之比 C.1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中c(OH-)之比 D.等物质的量浓度(NH4)2SO4和NH4Cl的C(NH4+)之比
第Ⅱ卷(共52分)
15、下列有关结论中,正确的是: A.在所有能够溶解Al(OH)3的溶液中,Cu2+、ClO-、Cl-、Ca2+一定能够大量共存
B.常温时将pH=3的CH3COOH溶液与pH=13的NaOH溶液等体积混合后溶液pH=7
C.常温下,在25 mL 0.1 mol·L﹣1 NaOH溶液中逐滴加入amL 0.2 mol·L﹣1CH3COOH溶液,当c(CH3COO-)>c(Na+)时,a一定大于12.5
D.在相同条件下,将足量AgCl加入等体积的①0.01 mol·L-1 KCl②0.1 mol·L-1 KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
14、下列溶液中各微粒的浓度关系正确的是:
A.pH=x的氨水与pH=y的盐酸等体积混合所得溶液中(已知x+y=14):
C(Cl_) > C(NH4+) > C(H+) > C(OH_)
B.0.1mol/LKHC2O4溶液中:C(K+)+C(H+)=C(HC2O4_)+C(OH_)+C(C2O42_)
C.1L0.1mol/LCuSO4·(NH4)2SO4·6H2O的溶液中:
C(SO42_) >C(NH4+) >C(Cu2+) >C(H+) >C(OH_)
D.0.1mol/LNa2HPO4的溶液中:C(OH_)=C(H+)+C(H2PO4_)+2C(H3PO4)
13、CO2和H2的混合气体加热到850℃时,建立下列平衡:CO2(g)+H2(g)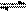 CO(g)+H2O(g)在一定温度下,反应平衡时有80%的氢气变成水,且c(CO2)×c(H2)=c(CO)×c(H2O),则原混合气体中CO2和H2分子数之比是:
CO(g)+H2O(g)在一定温度下,反应平衡时有80%的氢气变成水,且c(CO2)×c(H2)=c(CO)×c(H2O),则原混合气体中CO2和H2分子数之比是:
A.1:1 B. 4:1 C. 5:1 D.1:4
12、已知可逆反应2NO2(g)
 N2O4(g);△H<0;若初始温度相同,分别将等量的NO2气体置于编号为a、b、c的三个体积相同的密闭容器中,且已知a容器绝热恒容、b容器恒温恒容、c容器恒温恒压,则达到平衡后有关三个容器中气体颜色深浅的叙述中正确的是:
N2O4(g);△H<0;若初始温度相同,分别将等量的NO2气体置于编号为a、b、c的三个体积相同的密闭容器中,且已知a容器绝热恒容、b容器恒温恒容、c容器恒温恒压,则达到平衡后有关三个容器中气体颜色深浅的叙述中正确的是:
A. a容器颜色比b容器的深 B. b容器颜色比c容器的深
C. 题中条件无法确定哪个容器颜色最浅 D.三个容器种颜色一样
11、在一定条件下,已达平衡的可逆反应:2A(g)+B(g) 2C(g),下列说法中正确的是:
2C(g),下列说法中正确的是:
A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=
B.改变条件后,该反应的平衡常数K一定不变
C.如果改变压强并加入催化剂,平衡常数会随之变化
D.若平衡时增加A和B的浓度,则平衡常数会减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com