
题目列表(包括答案和解析)
2.NA表示阿伏加德罗常数,下列说法中正确的是( )
A.200mL1mol·L-1Fe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
B.将含有NO2和N2O4分子数共约6.02×1023个的混合气体温度降至标准状况时,其体积约为22.4L
C.一定条件下,向密闭容器中加入l mol N2和3molH2,反应结束后,转移的电子数为6NA
D.常温常压下,100mL 0.1 mol·L-1 HCl 溶液中含Cl- 数目为 0.0lNA
1.下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
A.蒸馏水、氨水、氧化铝、二氧化硫
B.盐酸、空气、硫酸、干冰
C.胆矾、盐酸、铁、碳酸钙
D.生石灰、漂白粉、氯化铝、碳酸钠
20.(本题14分)
如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
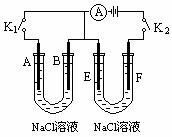 (1)打开K2,闭合K1时。B为 极,A的电极反应为
,最终可观察到的现象是 ,涉及的化学反应方程式有:
(1)打开K2,闭合K1时。B为 极,A的电极反应为
,最终可观察到的现象是 ,涉及的化学反应方程式有:
;
。
(2)打开K1,闭合K2时。E为___________极,F极的电极反应为________ __________,检验F极产生气体的方法是___________ ____________________。
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是__________,原因是__________________________
19.(10分)在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡。
(1)0min-4min内生成O2的平均速率v(O2)=________________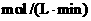
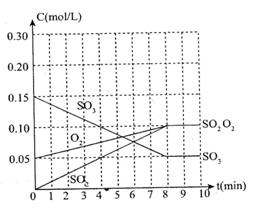 (2)整个过程中,各物质的浓度与时间关系如图所示,
(2)整个过程中,各物质的浓度与时间关系如图所示,
则该温度下的平衡常数K=_____________________
(3)若起始时按下表数据投料,相同温度下达到平衡时, 三氧化硫浓度大于0.05mol/L的是__________,此时的平衡常数与(2)小题比较_____________(填“大于”、“小于”或“等于”)
|
|
A |
B |
C |
D |
|
SO3 |
1mol |
3mol |
3mol |
0mol |
|
SO2 |
2mol |
1.5mol |
0mol |
6mol |
|
O2 |
2mol |
1mol |
0mol |
5mol |
(4)物质的浓度不再改变标志该反应已达平衡,下列还可以说明该反应已达平衡
的是_____(填序号)
①体系内压强不再改变 ②容器内气体的密度不再改变
③混合气体的平均分子量不再改变 ④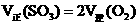
⑤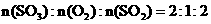
18.(12分)下图中各方框中的字母表示有关的一种反应物或生成物(某些物质略去)其中常温下B、D、G、I、J为气体,其中B可使湿润的红色石蕊试纸变蓝,A-N的所有物质中只有G为单质,其余为化合物。N为不溶于水的无机酸。
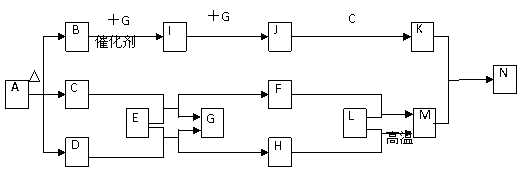
回答下列问题:
(1)A的名称为 ,F的化学式是 ;H的化学式是 ,L的化学式是
(2)写出实验室制取I的离子方程式:
(3)写出G的一种同素异形体的化学式: 该物质与G在化学性质上的共同点是 。
(4)已知工业上生产0.1molB放出4.62kJ热量,写出该反应的热化学方程式:
(5)在反应C+E→G+F中,每生成1molG转移 mol电子。
17.(13分)某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
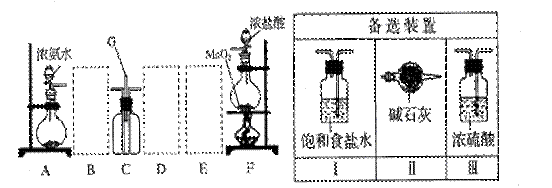
请回答下列问题:
(1)装置F中发生反应的离子方程式是 。
(2)装置A中的烧瓶内固体可选用 (选填以下选项的代号)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格。B 、D 、E 。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵: 。
(5)若从装置C和G处逸出的尾气中含有N2和少量C12,应如何处理?
。
16.(14分)某可逆反应的反应过程中能量变化如下图所示,回答下列问题。
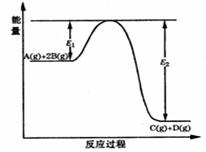 (1)若E1=215kJ·mol-1,E2=625kJ·mol-1,则该反应的热化学方程式为
。
(1)若E1=215kJ·mol-1,E2=625kJ·mol-1,则该反应的热化学方程式为
。
(2)当反应达到平衡时,降低温度,A的转化率
(填“增大”“减小”或“不变”),原因 是 。
(3)该反应的平衡常数表达式为K= ,升高温度平衡常数K (填“增大”、“减小”、“不变”或“可能增大,也可能减小”)。
(4)在反应体系中加入催化剂,反应速率增大,则 (用字母代号填空)。
A.E1减小,E2减小,反应热不变 B.E1减小,E2减小,反应热减小
C.E1减小,E2增大,反应热减小 D.E1增大,E2增大,反应热增大
(5)在一个容积不变的容器中加入一定量的A和B发生上述反应,下列图像符合该反
应的是____ (填序号)(图中v是速率、∅为气体D的体积分数,T为温度)
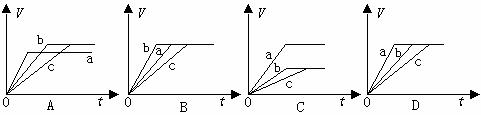
15.等质量的三份锌a、b和c,分别加入足量稀硫酸中,a中同时加入适量硫酸铜溶液,c中加入适量CH3COONa。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中正确的是 ( )
第Ⅱ卷 非选择题(共63分)
14.蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别 在充电和放电时发生的反应:Fe+NiO2+2
H2O Fe(OH)2+Ni(OH)2 下列有关对爱迪生
Fe(OH)2+Ni(OH)2 下列有关对爱迪生
蓄电池的推断错误的是( )
A.放电时,Fe是负极,NiO2是正极
B.充电时,阴极上的电极反应式为Fe(OH)2+2e-====Fe+2OH-
C.放电时电解质溶液中的阴离子是向正极方向移动
D.蓄电池的电极必须浸入碱性电解质溶液中
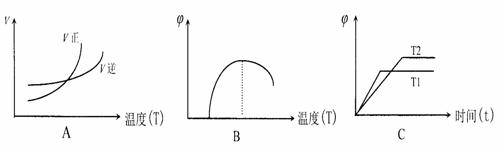
13. 可逆反应mA(g) nB(g)+pC(s) △H=Q, 温度和压强的变化对正、逆反应
可逆反应mA(g) nB(g)+pC(s) △H=Q, 温度和压强的变化对正、逆反应
速率的影响分别符合右图中的两个图像,以下叙述正确的是:( ) ( )
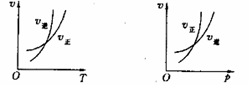 A.m>n,
Q>0
A.m>n,
Q>0
B.m>n+p,Q>0
C.m>n,Q<0
D.m<n+p, Q <0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com