
题目列表(包括答案和解析)
9.在100mL 0.10mol/L的AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入100mL溶有0.010mol CuSO4·5H2O的溶液,充分反应,反应后溶液体积变化忽略不计。下列说法中正确的是 ( )
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.01mol/L
8.下列说法正确的是 ( )
A.通过化学变化一定能改变物质性质 B.阴离子只有还原性
C.金属与盐溶液反应都是置换反应 D.失e-难的原子,一定易得e-
7.PbO2在酸性溶液中能将Mn2+氧化成MnO4-,本身被还原为Pb2+。取一支试管,加入适量PbO2固体和适量的稀H2SO4后滴入2mL 1mol/L MnSO4溶液。下列说法错误的是 ( )
A.充分振荡后静置,溶液颜色变为紫色
B.上述实验中不能用盐酸代替硫酸
C.若上述实验完全反应,消耗PbO2的物质的量为0.01mol
D.在酸性条件下,PbO2的氧化性比MnO4-的氧化性强
6.将标准状况下,将VL A气体(摩尔质量为M g/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为 ( )
A.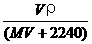 B.
B.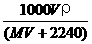
C.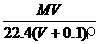 D.1000VρM(MV+2240)
D.1000VρM(MV+2240)
5.下列各组离子在指定溶液中一定能大量共存的是 ( )
①无色溶液中:K+、Na+、Cr2O72-、SO42-
②pH=11的溶液中:CO32-、Na+、NO3-、Al(OH)4-
③加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤在溶液中能大量共存,加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、AlO2-
⑥能使酚酞变红色的溶液:Na+、C1-、S2-、SO32-
A.①③⑤ B.②④⑤ C.②④⑥ D.④⑤⑥
4.用NA表示阿伏加德罗常数,下列叙述中不正确的是 ( )
A.在标准状况下,NA个甲基(-CH3)和NA个羟基(-OH)所含电子数相等
B.1mol Fe与足量氯气反应时,铁失去的电子数目为3NA
C.120g由NaHSO4和KHSO3组成的混合物中含硫原子数目为NA
D.1molCH3+中含有电子数为10NA
3.下列离子方程式书写正确的是 ( )
A.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
B.亚硫酸氢钠水解:HSO3-+H2O
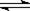 SO32-+H3O+
SO32-+H3O+
C.氧化铁溶于氢碘酸:Fe2O3+6H+ = 2Fe3++3H2O
D.用石墨电极电解NaCl溶液:2Cl-+2H2O  2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
2.在V L硫酸铁溶液中,含有Wg的SO42-,这种溶液中Fe3+的物质的量浓度为 ( )
A.W/144V B.W/64V C.W/96V D.3W/56V
1.下列对“摩尔(mol)”的叙述不正确的是 ( )
A.摩尔是一个物理量
B.摩尔是一个单位,用于计量物质所含微观粒子的多少
C.摩尔既能用来计量纯净物,又能用来计量混合物
D.1mol任何气体所含的气体分子数目都相等
23.有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热。产生1.12L气体(标准状况),则样品①中氧化铜的质量为 g。
(2)乙取样品② a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为 。样品②中氧化铜质量为 g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,
则样品③中氧化铜物质的量(n)的取值范围为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com