
题目列表(包括答案和解析)
5、在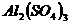 、
、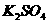 和明矾的混合溶液中,如果
和明矾的混合溶液中,如果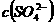 =0.2 mol/L ,当加入等体积的0.2
mol/L 的
=0.2 mol/L ,当加入等体积的0.2
mol/L 的 溶液时,生成的沉淀恰好溶解,则原混合物中
溶液时,生成的沉淀恰好溶解,则原混合物中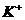 的浓度为( )
的浓度为( )
A、0.2 mol/L B、0.25 mol/L C、0.45 mol/L D、0.225 mol/L
4、设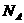 为阿伏伽德罗常数,下列说法中不正确的是( )
为阿伏伽德罗常数,下列说法中不正确的是( )
A、质子总数为5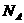 的重水(
的重水( )物质的量是0.5 mol
)物质的量是0.5 mol
B、标准状况下,2.24L氧单质中所含的原子数一定为0.2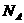
C、6g
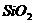 所含的共价键的数目为0.4
所含的共价键的数目为0.4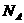
D、1L
0.1mol·L-1的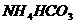 溶液中所含
溶液中所含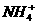 数量小于0.1
数量小于0.1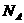
3、在100℃时将甲醇、甲烷、氧气的混合气体放入一装有过量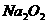 固体的密闭容器中,不断用电火花引燃,充分反应后,测得密闭容器内气体压强为零,则原混合气体中甲醇、甲烷、氧气的体积比可能是( )
固体的密闭容器中,不断用电火花引燃,充分反应后,测得密闭容器内气体压强为零,则原混合气体中甲醇、甲烷、氧气的体积比可能是( )
A、1﹕1﹕1 Blog/?UserId=997609 Blog/?UserId=997609 B、2﹕2﹕1 Blog/?UserId=997609 Blog/?UserId=997609 C、1﹕3﹕2 Blog/?UserId=997609 Blog/?UserId=997609 D、无法计算
2、“神舟七号”飞船所用的长征二号F运载火箭,使用偏二甲肼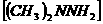 作为燃料,升空时发生的化学反应为:
作为燃料,升空时发生的化学反应为: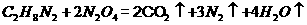 。下列有关该反应的说法正确的是( )
。下列有关该反应的说法正确的是( )
A、该反应的氧化剂是偏二甲肼
B、该反应进行时只有放热过程没有吸热过程
C、该反应中氮元素的化合价升高
D、该反应中每生成1 mol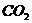 转移8 mol电子
转移8 mol电子
1、下列叙述不正确的是( )
A、奥运火炬的燃料使用丙烷而不用煤油是为了减少空气污染
B、抗冰雪灾害时使用的融雪剂所含的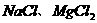 等盐可使水的冰点降低
等盐可使水的冰点降低
C、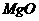 可用作耐高温材料,是因为
可用作耐高温材料,是因为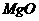 属于原子晶体,熔点高
属于原子晶体,熔点高
D、食品加工过程中,使用食品添加剂,要严格控制使用量以保障食品安全
24.计算题
将32克铜与100 ml一定浓度的硝酸反应,铜完全溶解,产生的NO和 NO2在标准状况下的体积为11.2L。请计算:(写出计算过程)
(1) NO和 NO2的体积分别是多少?
(2)待产生的气体全部释放后,向溶液中加入Vml amol/L的NaOH溶液,恰好使溶液中的
的Cu2+ 全部转化为沉淀,则原溶液的浓度为多少?
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3 ,至少需要O2的体积是多少?
23.下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用作工业上冶炼金属的还原剂。请按要求填空:

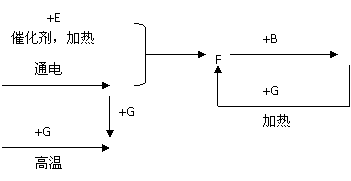
 A
D
A
D
|
B E
C H
(1) 写出下列物质的化学式:A_________;B_________;C___________
(2) 写出F+B→I的化学方程式___________________________________
(3) 写出G和I的浓溶液反应的化学___________________________________ .
22.今有一无色透明溶液,只可能含有以下离子中的若干中:K+、H+、Mg2+、Fe3+、Ba2+、SO42-、CO32-、NO3- ,现取二份各100 mL溶液进行如下实验:
①第一份加足量NaHCO3 溶液加热后,收集到气体0.04mol
② 第二份加足量Ba(NO3)2 溶液充分反应后过滤干燥,得沉淀4.66g.
根据上述实验回答
⑴溶液中一定不存在的离子是______________________;
⑵溶液中可能存在的离子是________________________;
⑶ 写出①发生反应的离子方程式
_________________________________________________________;
⑷写出②发生反应的离子方程式
__________________________________________________________.
21.用98%的浓H2SO4(密度是1.84g/cm3)配制成0.5 mol/L的稀H2SO4500mL的操作步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解④转移、洗涤 ⑤定容、摇匀,请按要求填空:
⑴需量取的浓硫酸体积为______,应选用______量筒(实验室有10mL,20mL,50mL的量筒).
⑵.本实验需用到的基本实验仪器除烧杯、玻璃棒外还有:
_________________________________________________ 。
⑶.某学生的下列操作中使浓度偏低的是:___________
①用量筒量取浓硫酸时,仰视读数。
②量筒中浓硫酸全部转入烧杯中稀释后,再转移到100mL容量瓶中,烧杯未洗涤。
③用玻璃棒引流,将溶液转移到容量瓶中有溶液流到了容量瓶外面。
④用胶头滴管加蒸馏水时,加入过快而使液面超过了刻度线,立即用滴管吸去多余的水,使溶液凹液面刚好与刻度线相切。
⑤滴加蒸馏水,使溶液凹液面刚好与刻度线相切,盖上瓶塞反复摇匀后,静置,发现液面比刻度线低,再加水至刻度线。
⑥溶液定容时,俯视容量瓶刻度线。
20.已知常温下,在溶液中发生如下反应:
① 16H++10Z-+2XO4-===2X2++5Z2+8H2O; ② 2A2++B2===2A3++2B-;
③ 2B-+Z2===B2+2Z-
由此判断下列说法错误的是 ( )
A. 反应Z2+2A2+===2A3++2 Z-可以进行
B. Z元素在①的反应中被氧化
C. 氧化性由强到弱的顺序是:XO4-、Z2、B2、A3+
D. 还原性由强到弱的顺序是:Z-、B-、A2+、X2+
第Ⅱ卷(共40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com