
题目列表(包括答案和解析)
4、下列离子方程式书写正确的是
A.碳酸钙溶于过量醋酸:CaCO3 + 2CH3COOH== Ca2+ + 2CH3COO- + CO2 ↑+ H2O
B.氯气溶于水: Cl2 + H2O== 2H+ + Cl- + ClO-
C.过量的二氧化碳通入硅酸钠溶液中:CO2 + H2O+SiO32-== H2SiO3 ↓+2HCO3-
D.用惰性电极电解AgNO3溶液:Ag+ + 2H2O==Ag↓ + 4H+ +O2↑
3、下列现象或事实可用同一原理解释的是
A.氯水和二氧化硫使品红溶液褪色
B.苯粉和氯化亚铁长期露置于空气中变质
C.亚硫酸钠和硅酸钠、漂白粉长期暴露在空气中变质
D.Al2(SO4)3溶液和NaHSO4溶液分别与NaHCO3溶液混合均放出CO2气体
2、下列叙述正确的是( )
A、标准状况下,16gSO3的体积约为4.48L。
B、1L 0.5mol·L-1的Na2CO3溶液中C(CO32-)=0.5mol·L-1
C、5.6g 铁和氯气充分反应,转移的电子数为1.204×1023
D、由CO2和SO2组成的混合物中共有NA个分子,其中的氧原子数为2NA。
1、化学与生产、生活、科技密切相关,下列说法不正确的是( )
A、利用硅作材料制成的光伏发电装置,既有利于环保又有利于解决能源的不足。
B、二氧化硫可以用来作食物和干果的防腐剂
C、二氧化硅可用来制造集成电路、晶体管
D、臭氧是家用消毒柜的消毒剂。
21、(16分)如图,有甲、乙两容器,甲体积可变,压强不变,乙保持体积不变。向两容器中分别充入1 molA、3 molB,此时两容器体积均为500 ml。保持两容器温度相同且不变,发生反应
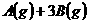
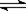
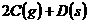 ;△H<0。
;△H<0。

(1)下列选项中能表明甲和乙容器中反应一定达到平衡状态的是( )
A、混合气体的总质量不随时间改变 B、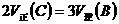
C、A、B转化率相等 D、物质D的质量不随时间而变
(2)2min后甲容器中反应达到平衡,测得C的浓度为2 mol·L-1。此时容器的体积为
mL,B的转化率为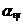 (B)为
。用A的物质的量变化表示该反应的平均反应速率为
。
(B)为
。用A的物质的量变化表示该反应的平均反应速率为
。
(3)乙容器中反应达到平衡所需时间
2min(填>、<或=),B的转化率 (B)
(B) 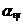 (B)(填>、<或=)。
(B)(填>、<或=)。
(4)其他条件不变,甲中如果从逆反应开始建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需起始加入C的物质的量n(C)= mol,加入D的物质的量n(D)应满足的条件为 。
20、
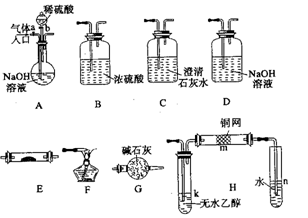 (16分)右图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(16分)右图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO。选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置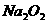 ,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应
,活塞b应 ,需要加热的仪器装置有
(填代号),m中反应的化学方程式为
。
,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应
,活塞b应 ,需要加热的仪器装置有
(填代号),m中反应的化学方程式为
。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E
内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有:
。
②实验中观察到E内有红棕色气体出现,证明氨气具有 性。
19、 (10分)右图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:
(10分)右图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:

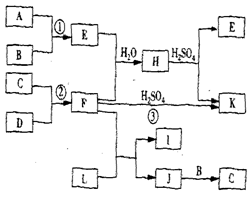 (a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由
(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由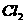 与
与 溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32.(f)化合物H的组成中阳离子和阴离子数目为
1﹕1.
溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32.(f)化合物H的组成中阳离子和阴离子数目为
1﹕1.
 请按要求填空:
请按要求填空:
 (1)反应③的化学方程式
。
(1)反应③的化学方程式
。
 (2)C的结构式
;H的化学式
。
(2)C的结构式
;H的化学式
。
 (3)L的溶液与化合物E反应的离子方程式
。
(3)L的溶液与化合物E反应的离子方程式
。
 (4)化合物J的化学式
。
(4)化合物J的化学式
。
18、 (10分)短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(10分)短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

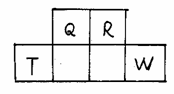 (1)T的原子结构示意图为
。
(1)T的原子结构示意图为
。
 (2)元素的非金属性Q W(填>或<或=)。
(2)元素的非金属性Q W(填>或<或=)。
 (3)W的单质与其最高价氧化物的水化物浓溶液共热生成两种物质,其中一种是气体,反应的化学方程式为
。
(3)W的单质与其最高价氧化物的水化物浓溶液共热生成两种物质,其中一种是气体,反应的化学方程式为
。
 (4)原子序数比R多1的元素有两种氢化物,通过分解反应二者可实现转化的反应方程式为
。
(4)原子序数比R多1的元素有两种氢化物,通过分解反应二者可实现转化的反应方程式为
。
 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下2L甲与0.5L
O2相混合,若该混合气被足量NaOH溶液吸收后无气体残留,且生成的R含氧酸盐只有一种,则该盐的化学式是
。Blog/?UserId=997609
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下2L甲与0.5L
O2相混合,若该混合气被足量NaOH溶液吸收后无气体残留,且生成的R含氧酸盐只有一种,则该盐的化学式是
。Blog/?UserId=997609
17、 (8分)某温度时,水的离子积常数Kw=1.0×10-13,将此温度下PH=11的
(8分)某温度时,水的离子积常数Kw=1.0×10-13,将此温度下PH=11的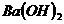 溶液aL与PH=1的
溶液aL与PH=1的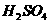 溶液bL混合。该混合液体积为两者之和,所得固体体积忽略不计。
溶液bL混合。该混合液体积为两者之和,所得固体体积忽略不计。
 (1)若所得混合液为中性,则a﹕b=
,生成沉淀的物质的量为 (用含a、b的表达式表示)。
(1)若所得混合液为中性,则a﹕b=
,生成沉淀的物质的量为 (用含a、b的表达式表示)。
 (2)若a﹕b=9﹕2,则所得溶液PH=
,该混合液最多能够溶解铁粉 g。
(2)若a﹕b=9﹕2,则所得溶液PH=
,该混合液最多能够溶解铁粉 g。
16、 下列溶液中有关微粒的浓度关系正确的是( )
下列溶液中有关微粒的浓度关系正确的是( )
 A、
A、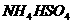 溶液中加入
溶液中加入 至溶液呈中性;
至溶液呈中性;
 B、PH相等的
B、PH相等的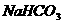 、
、 、
、 溶液:
溶液: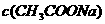 >
> >
>
 C、
C、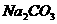 溶液:
溶液: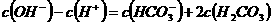
 D、25℃时PH=4.,浓度均为0.1
mol·L-1的
D、25℃时PH=4.,浓度均为0.1
mol·L-1的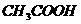 与
与 的混合溶液:
的混合溶液:

 第Ⅱ卷 非选择题(共60分)
第Ⅱ卷 非选择题(共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com