
题目列表(包括答案和解析)
4、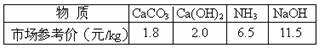 某工厂废液中含有少量硫酸,拟选用下列物质中和后再排放: 如果要求花最少的钱来中和相同量的废硫酸,则应选择( )
某工厂废液中含有少量硫酸,拟选用下列物质中和后再排放: 如果要求花最少的钱来中和相同量的废硫酸,则应选择( )
A.CaCO3 B.Ca(OH)2 C.NH3 D.NaOH
3、下列各组离子在水溶液中能大量共存的是( )
A.Na+、HS–、Cu2+、Cl–
B.HS–、Na+、OH–、K+
C.K+、CO32–、Br–、AlO2–
D.H+、Cl–、Na+、SO32–
2、FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时生成H2S2,H2S2类似H2O2易分解。实验室用稀盐酸与FeS2颗粒混合,则反应完毕后不可能生成的物质是( )
A.H2S B.S C.FeS D. FeCl2
1、生活中的许多问题常涉及到化学知识。下列有关叙述不正确的是
A.次氯酸和臭氧都是强氧化剂,都能杀死细菌。我国的自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质
B.因为废旧电池会对生态环境和公众健康造成危害,所以废旧电池必须回收
C.明矾常作净水剂,但人体摄入大量铝易患“失忆性痴呆”,故饮用水生产过程中不能大量用明矾作净水剂
D.氟氯烃属于卤代烃,是制冷效果很好的致冷剂,但它会破坏臭氧层,科研人员正在积极研发环保型的替代产品以减少氟氯烃的使用
22、过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化的含量。请填写下列空白:
(1)移取10.00 m密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
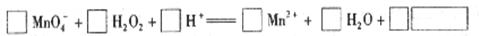
(3) 滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是 。
(4) 复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(5) 若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学举小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾演粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)请将他们的实验方法和实验现象填入下表:
|
实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
|
验证氧化性 |
|
|
|
验证不稳定性 |
|
|
21、常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3・H2O
(1)上述溶液中,可发生水解的是 (填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度大到小的顺序为 。
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值 (填增大、减小、不变)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填
大于、小于、等于),此时溶液中离子浓度由大到小的顺序是 。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
20、T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。
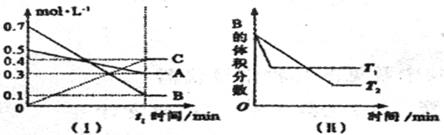 根据以上条件,回答下列问题:
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为 ,
正反应为 (填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆方向移动的有
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.其他条件不变,升高湿度
(3)T℃时,在相同容积的1L容器中,起始充入amolA,bmolB和0.2molC于容器中,达到平衡后B的体积分数与t1时B的体积分数相同。则a= ,b= 。
18、 R、X、Y、Z、W是常见的短周期元素,它们的原子半径依次增大。W是一种很强的还原剂,也应用在电光源上。Y元素的一种同素异形体是家用消毒柜常用的消毒剂,Z单质形成的常见晶体类型有三种。X是形成氧化物种类最多的非金属元素。R元素的原子核内无中子。
R、X、Y、Z、W是常见的短周期元素,它们的原子半径依次增大。W是一种很强的还原剂,也应用在电光源上。Y元素的一种同素异形体是家用消毒柜常用的消毒剂,Z单质形成的常见晶体类型有三种。X是形成氧化物种类最多的非金属元素。R元素的原子核内无中子。
 ⑴ZY2属于 分子(A、极性 B、非极性)。其结构式
⑴ZY2属于 分子(A、极性 B、非极性)。其结构式
 ⑵实验室制取XY的离子方程式
⑵实验室制取XY的离子方程式
 ⑶RYZ三种元素组成的一种芳香味的化合物,在酸性条件下加热水解,生成两种摩尔质量相等的化合物,其中一种是乙醇,则另一种物质不具有的化学性质有
⑶RYZ三种元素组成的一种芳香味的化合物,在酸性条件下加热水解,生成两种摩尔质量相等的化合物,其中一种是乙醇,则另一种物质不具有的化学性质有
 A、能和小苏打溶液反应,生成能使澄清石灰水变浑浊的气体。
A、能和小苏打溶液反应,生成能使澄清石灰水变浑浊的气体。
 B、能发生银镜反应
B、能发生银镜反应
 C、能和氢气在一定条件下发生加成反应
C、能和氢气在一定条件下发生加成反应
 D、能使酸性高锰酸钾溶液退色
D、能使酸性高锰酸钾溶液退色
 E、能发生消去反应。 D、能发生酯化反应
E、能发生消去反应。 D、能发生酯化反应

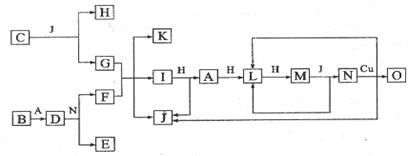 19、已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
19、已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
 请回答下列问题:
请回答下列问题:
(1)组成B单质的元素位于周期表第_____周期,第_______族。化合物C的电子式为_______。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是_________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_____________________。Blog/?UserId=997609
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有____个。
17、 已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是
 A.0.01 mol·L-1的蔗糖溶液
B. 0.01 mol·L-1的氯化钙溶液
A.0.01 mol·L-1的蔗糖溶液
B. 0.01 mol·L-1的氯化钙溶液
 C.0.02 mol·L-1的氯化钾溶液 D.
0.02 mol·L-1的醋酸溶液
C.0.02 mol·L-1的氯化钾溶液 D.
0.02 mol·L-1的醋酸溶液

 第Ⅱ卷(49分)
第Ⅱ卷(49分)
16. 用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是:Blog/?UserId=997609

 A.PbO
B.Pb2O3 C.Pb3O4 D.PbO2
A.PbO
B.Pb2O3 C.Pb3O4 D.PbO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com