
题目列表(包括答案和解析)
16、在化工试剂生产中,要除去某种杂质离子,往往采用一定条件下使之生成MXAy(DE4)Z(OH)12浅黄色复盐晶体析出。化学式中OH为氢氧根,而M、A、D、E代表四种未知元素。已知⑴X+Y+Z=12(x、Y、Z为正整数)。⑵取9.7g该化合物溶于含有稀硝酸的水中,滴加硝酸钡溶液,使D、E元素完全转变为白色沉淀,过滤干燥后称量为9.32g。⑶滤液中A、M以阳离子形式存在,用胶头滴管滴滤液2-3滴在白色点滴板(或玻璃片)上,再滴加1-2滴硫氰化钾溶液,溶液呈血红色。⑷往滤液中通入足量的硫化氢气体,使A离子全部被还原后,产生黄色沉淀物,过滤干燥后,称量为0.96g。⑸化合物中A元素的百分含量为34.64%。试通过计算推理判断:
⑴ 确定D和E: 、 (写元素符号)。
⑵ 确定x、y、z和A: x==_________、y==___________、z==_________、A是____________________。
⑶ M代表的元素是______________;化合物的化学式为____________________。
15、元素的电离能对元素的性质影响很大。
(1)观察下表总结三条有关第一电离能变化的规律
例如:同周期主族元素的第一电离能的变化趋势是由小变大;
;
;
。
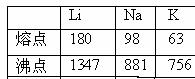 (2)根据这三个图表回答:(M表示碱金属)
(2)根据这三个图表回答:(M表示碱金属)
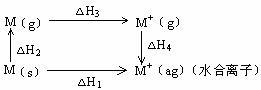
△H2(Li) △H2(Na), △H3(Li) △H3(Na),已知金属锂比钠活泼,则△H4(Li) △H4(Na)。
(3)钒(V)原子的基态电子排布式为: ,钒元素的最高化合价为 。
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
14. 在密闭容器中有可逆反应:nA(g)+mB(g)
pC(g)
△H>0处于平衡状态,(已知m+n>p),则下列说法正确的是
在密闭容器中有可逆反应:nA(g)+mB(g)
pC(g)
△H>0处于平衡状态,(已知m+n>p),则下列说法正确的是
①升温,c(B)/c(C)的比值变小②降温时体系内混合气体平均分子量变小③加入B,A的转化率增大 ④加入催化剂,气体总的物质的量不变⑤加压使容器体积减小,A或B的浓度一定降低⑥若A的反应速率为VA,则B的反应速率为n·VA /m
 A.①②③⑤ B.①②③④ C.①②⑤⑥ D.③④⑤⑥
A.①②③⑤ B.①②③④ C.①②⑤⑥ D.③④⑤⑥
0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是:
A.因为A2-+H2O  HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
13.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A
= H+ + HA-,HA- H++A2-,又知
H++A2-,又知
12、某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
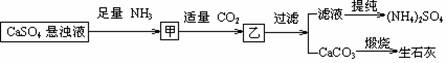
下列推断不合理的是
A.往甲中通适量CO2有利于(NH4)2SO4生成 B.生成1mol(NH4)2SO4至少消耗2 NH3
C.CO2可被循环使用 D.直接蒸干滤液能得到纯净的(NH4)2SO4
11、向含有AgNO3和Cu(NO3)2和 Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体上滴加稀硫酸,有气泡产生,则滤出的固体一定是
Ag、Cu两种单质的混合物 B. Ag、Cu、Zn三种单质的混合物
C. Ag、Cu、Fe三种单质的混合物 D. Ag、Cu、Zn、Fe四种单质的混合物
10、 以下物质间的每步转化通过一步反应能实现的是
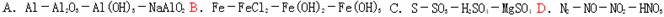
9、下列反应的离子方程式正确的是
A.在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:Mg2+ +2HCO3-+Ca2+ +2OH-=MgCO3↓ + CaCO3↓ + 2H2O
B.电解饱和食盐水:
C.过量的铁与浓硝酸反应: Fe+6H++3NO3- = Fe3+ 十3NO2↑+3H2O
D.纯碱溶液与胆矾溶液混合生成正盐、酸式盐、碱式盐: 3CO32-+2Cu2++2H2O=2HCO3-+Cu2(OH)2CO3↓
8、 只给出右表中甲中和乙中对应的量,可以组成一个物质的量的公式的是( )
只给出右表中甲中和乙中对应的量,可以组成一个物质的量的公式的是( )
A.①② B.①②③
C.①②④ D.①②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com