
题目列表(包括答案和解析)
10、NO2-既有氧化性,又有还原性。NaNO2大量进入血液时,能将血红蛋白中的Fe2+氧化成Fe3+,正常的血红蛋白转化为高价铁血红蛋白,失去携氧功能,引起中毒,甚至死亡。下列各组试剂不能检验NO2-的是
A.FeCl2和KSCN B.AgNO3和HNO3 C. KMnO4和H2SO4 D.KI和淀粉
9、下列离子方程式书写正确的是( )
A.三氯化铝溶液中加人过量氨水
Al3++3OH- Al(OH)3↓
Al(OH)3↓
B. 稀硝酸中加入过量的铁粉:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O
C.用碳酸钠溶液吸收少量二氧化硫 2CO32-+SO2+H2O ==2HCO3-+SO32-
D. 盐酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
8、向一种溶液中滴加另一种溶液,振荡,溶液的颜色一定不会发生明显变化的是
A.向K2Cr2O7溶液中滴加少量浓NaOH溶液 B.向氢氧化钠溶液中滴加少量明矾溶液
C.向淀粉碘化钾溶液中滴加少量稀硫酸 D.向氯化亚铁溶液中滴加少量铁氰化钾溶液
7、.三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:C3N3(OH)3
 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2
 7N2+8CO2+4H2O 下列说法正确的是
7N2+8CO2+4H2O 下列说法正确的是
A.C3N3(OH)3与HNCO为同一物质 B.HNCO是一种很强的氧化剂
C.1 molNO2在反应中转移的电子为4mol D.反应中NO2是还原剂
6、下列各组离子在溶液中能大量共存,加入Fe2(SO4)3后仍能大量共存的是
A. Na+、I-、CO32-、ClO-
B. Fe2+、H+、K+、NO3-
C. Ba2+、Na+、SCN-、Cl-
D. Cu2+、Mg2+、Cl-、NO3-
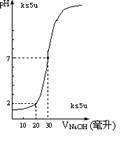
5、右图为10mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH
溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量的浓度是( )
|
|
A |
B |
C |
D |
|
C(HCl)(mol/L) |
0.12 |
0.04 |
0.18 |
0.09 |
|
C(NaOH)(mol/L) |
0.04 |
0.12 |
0.06 |
0.03 |
4、在雷达的微波过滤器里使用的铁氧磁性体,如钇铁石榴石Y3Fe5O12,其中Y是ⅢB族稀土元素。下面有关钇铁石榴石的叙述中正确的是( )
A .可表示为3YO3·3FeO·Fe2O3
B.可表示为Y3O5·Fe3O4·Fe2O3
C. 其中钇、铁的化合价均为+3价
D.其中钇、铁的化合价均有+2、+3价
3、已知:1mol 肼(N2H4)(g)与NO2在一定条件下,完全反应生成N2(g)和水蒸气放出567.85 kJ的热量。下列关于肼和NO2反应的热化学方程式中,正确的是:
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7 kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = +1135.7kJ/mol
 C.N2H4+ NO2
= 3/2N2+ 2H2O ;△H = –567.85kJ/mol
C.N2H4+ NO2
= 3/2N2+ 2H2O ;△H = –567.85kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7 kJ/mol
2、中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是( )
A. 用NaOH和HCl 反应测得的中和热,推算一定量稀H2SO4和NaOH 溶液反应的反应热
B. 用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性
C. 用沸点数据来分析分子的稳定性
D. 用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性强弱
1、生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是
A.Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂。
B.用灼烧并闻气味的方法区别纯棉织物和纯毛织物。
C.某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2。
D.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com