
题目列表(包括答案和解析)
5.下列方案中.能够使反应Cu+2H2O==Cu(OH)2↓+ H2↑发生的是( )。
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿的空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解硫酸铜溶液
4.A-D是含有同一元素的四种物质,相互之间有如图所示的转化关系,其中A既可为单质。又可为气态氢化物,D是最高价氧化物的水化物,则A、B、C、D中共同含有的元素是( )。
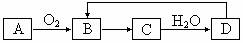 A.氯 B.铁
A.氯 B.铁
C.碳 D.氮
3.某温度下,向PH=6的纯水中加入一定量的盐酸,保持温度不变,测得溶液的pH=2,对于该溶液,下列叙述中不正确的是( )。
A.pH=6的纯水呈中性
B.该溶液的浓度c(HCl)=0.01mol·L-1
C.该溶液中水电离产生的c(H+)=10-10mol·L-1
D.该温度下加入等体积pH=12的NaOH溶液,即可恰好完全中和
2.用NA表示阿伏加德罗常数的值,下列说法正确的是( )。
A.1molFeCl3完全水解生成1molFe(OH)3胶粒
B.1mol -OH中含有的电子数为9NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.3.4g NH3中含N-N键数目为0.2NA
1.下列化工生产过程中不涉及氧化还原反应的是( )。
A.氯碱工业 B.硫酸工业 C.玻璃工业 D.合成氨工业
16.氢氧化镁是重要的绿色阻燃剂,氢氧化镁中含有少量氢氧化铁杂质,为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳生产条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,实验结果如下:
精制 Mg(OH)2的条件 Mg(OH)2的条件 |
阻燃剂 铁含量 |
|||
|
序号 |
分离体系 温度T/℃[ |
加入EDTA 质量(g) |
加入保险粉 质量(g) |
W(Fe)/(10-4g) |
|
1 |
40[ |
0.05 |
0.05 |
7.63 |
|
2 |
40 |
0.05 |
0.10 |
6.83 |
|
3 |
60 |
0.05 |
0.10 |
6.83 |
|
4 |
60 |
0.10] |
0.10 |
6.51 |
若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是
① 40℃ ② 60℃ ③EDTA质量为 0.05 g ④EDTA质量为 0.10 g
⑤保险粉质量为 0.05 g ⑥保险粉质量为 0.10 g
A.①③⑤ B.②④⑥ C.①④⑥ D.②③⑤
福建省东山二中2010届高三下学期模拟考试
15.从下列事实所得出的相应结论正确的是
|
|
实验事实 |
结论 |
|
① |
A元素的原子半径比B元素的原子半径大 |
周期表中A位于B的下一周期 |
|
② |
将CO2通入到Na2SiO3溶液中产生白色浑浊(H2SiO3) |
酸性:H2CO3 > H2SiO3 |
|
③ |
将燃烧的镁条放人CO2中能继续燃烧 |
还原性:Mg >
C |
|
④ |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P >
N |
|
⑤ |
某无色溶液中加入硝酸酸化的硝酸钡溶液产生白色沉淀 |
原溶液一定有SO42- |
A.②③ B.③④⑤ C.①②③⑤ D.全部
14.在给定条件的水溶液中一定能大量共存的离子组是
A.能与Al反应生成H2的溶液:Ca2+、NH4+、HCO3-、Cl-
B.存在多量Fe2+的溶液:H+、Na+、NO3-、SO42-
C.由水电离出的c(H+)=10-12mol/L的溶液:Na+、K+、Cl-、NO3-
D.c(H+):c(OH-)=1:10的溶液:K+、Ba2+、ClO-、CO32-
13.钢铁“发蓝”是指在钢铁的表面形成一层四氧化三铁的技术过程。化学方程式①②③表示钢铁 “发蓝”的变化原理,下列说法不正确的是
① 3Fe + NaNO2 + 5NaOH  3Na2FeO2 + H2O
+ NH3↑;
3Na2FeO2 + H2O
+ NH3↑;
② 6Na2FeO2 + NaNO2 + 5H2O
 3Na2Fe2O4 +
NH3↑+ 7NaOH;
3Na2Fe2O4 +
NH3↑+ 7NaOH;
③ Na2FeO2 + Na2Fe2O4
+ 2H2O  Fe3O4 + 4NaOH;
Fe3O4 + 4NaOH;
A.该生产过程会产生污染
B.反应②中的氧化剂是NaNO2
C.反应①②③均是氧化还原反应
D.整个反应过程中每有16.8 g Fe参加反应转移0.8 mol电子
12.已知:
Fe2O3(s)+C(s) = CO2(g)+2Fe(s) △H =+234.1 kJ·mol-1
C(s)+O2(g) = CO2(g) △H =-393.5 kJ·mol-1
则2Fe(s)+O2(g) = Fe2O3(s)的△H是
A.-824.4 kJ·mol-1 B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1 D.-169.4 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com