
题目列表(包括答案和解析)
3.逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是 ( )
A.化合物都是由不同元素组成的,不同元素组成的物质一定是化合物
B.铝位于金属活动性顺序表中氢的前面,所以其与硝酸反应一定放出氢气
C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
D.氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物
2.某物质经分析,只含一种元素,则此物质 ( )
A.一定是一种单质 B.一定是纯净物
C.一定是混合物 D.可能是纯净物,也可能是混合物
1.节能减排关系人类的生存环境,请从我做起。下列措施不属于“节能减排”的是( )
A.及时关灯、关空调、关水龙头,节水、节电
B.使用天然气热水器取代电热水器
C.自2008年6月1日起,实行塑料购物袋有偿使用
D.研制开发燃料电池汽车,减少机动车尾气污染
12.[化学--有机化学基础](13分)
簸箩酯是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸(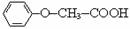 )
)
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是 。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3molH2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 。
(3)苯氧乙酸有多种类型的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意1种的结构简式) 。
(4)已知: ,
,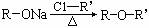 (R-、
(R-、 代表烃基)
代表烃基)
簸箩酯的合成线路如下:
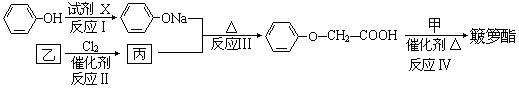
①试剂X不可选用的是(选填字母) 。
a.Na b.NaOH溶液 c.NaHCO3溶液
②丙的结构简式是 。
③反应Ⅳ的化学方程式是 。
11.[化学--物质结构与性质](13分)
已知和碳元素同主族的X元素位于周期表中的第一长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们所形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为 ;Y元素原子最外层电子的轨道表示式为 。
(2)若X、Y两元素电负性分别为1.8和3.0,则XY4中X与Y之间的化学键为
(填“共价键”或“离子键”)。
(3)该化合物的空间结构为 ,中心原子的杂化类型为 ,分子为 (填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该化合物中分子间作用力是 。
(5)该化合物的沸点与SiCl4比较, (填化学式)的较高,原因是
。
10.(15分)硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
[提出问题]Na2S2O3是否与Na2SO4相似从而具备下列性质呢?
猜想①: ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
[实验探究]基于上述猜想②、③,设计实验方案。
|
|
实验操作 |
实验现象或预期实验现象 |
现象解释(用离子方程式表示) |
|
|
A.
|
溶液pH=8 |
|
|
猜想② |
向pH=2的硫酸中滴加Na2S2O3溶液 |
B.
|
S2O32-+2H+==S↓+S02↑+H2O |
|
猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
C.
|
[实验结论]Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
[问题讨论]
(1)甲同学向“探究‘猜想③’”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由
。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是
。
选考部分
9.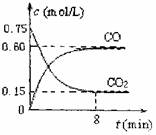 (14分)一定条件下铁可以和CO2发生反应:
(14分)一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并
充入一定量的CO2气体,反应过程中CO2气体和
CO气体的浓度与时间的关系如图所示,求8分钟
内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeCl3溶液可用于天然气脱硫,写FeCl3溶液与天然气中H2S反应的离子方程式:
。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式
。
8.(16分)原子序数递增的部分短周期主族元素的原子半径数据如下表:
|
元素 |
A |
B |
D |
E |
F |
G |
M |
N |
P |
|
原子半径/
nm |
0.077 |
0.070 |
0.066 |
0.064 |
0.186 |
0.160 |
0.143 |
0.104 |
0.099 |
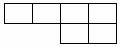 (1)已知A、B、D、E、N、P为非金属元素,且均不与F、G、M中的任何一种元素同族,在周期表中的相对位置如下,请将相应元素符号填在表中。
(1)已知A、B、D、E、N、P为非金属元素,且均不与F、G、M中的任何一种元素同族,在周期表中的相对位置如下,请将相应元素符号填在表中。
(2)B在周期表中的位置为 ;
AD2的电子式为 。
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为 。
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是 ,反应的化学方程式为 。
7.据悉,奥运会上使用的发令枪所用的”火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学反应方程式为:5KClO3 + 6P==3P2O5 + 5KCl,则下列有关叙述错误的是( )。
A.上述反应中氧化剂和还原剂的物质的量之比为5:6
B.上述反应中消耗3 mol P时,转移电子的物质的量为l5 mol
C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
D.产生白色烟雾是因生成的P2O5白色固体小颗粒吸收空气中的水分生成磷酸小液滴
第Ⅱ卷(非选择题共58分)
必考部分(共3题,共45分)
6.某些金属卤化物可跟其卤素反应,如KI + I2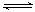 KI3(KI3易溶于水)。下列推断错误的是( )。
KI3(KI3易溶于水)。下列推断错误的是( )。
A.I3-溶液存在如下平衡:I3- 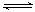 I2
+ I-
I2
+ I-
B.KI3溶液可用于检验淀粉的存在
C.在配制碘水时,加入KI可增大I2的溶解度
D.Kl3溶液中加入AgNO3溶液.会析出AgI3沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com