
题目列表(包括答案和解析)
13.25℃时,有关弱酸的电离平衡常数如下:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
下列有关说法正确的是 ( )
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
12.有机物A的分子式为C3H6O2,水解后得到一元酸M和一元醇N,已知M、N的相对分子质量相等,则下列叙述中不正确的是 ( )
A.M、N均不能发生银镜反应 B.M中含碳的质量分数约为26%
C.M中无甲基 D.N分子中含有甲基
11、A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是 ( )
A.A和B一定是同分异构体 B.A和B不可能是同系物
C.A和B最简式一定相同 D.A和B的化学性质相似
10.下列叙述正确的是 ( )
A.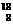 O与
O与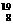 O是不同的核素,因此分别由这两种原子组成的分子其化学性质不同
O是不同的核素,因此分别由这两种原子组成的分子其化学性质不同
B.常温下,pH=1的水溶液中Na+、ClO-、HCO3-、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s) ΔH>0,所以石墨比金刚石稳定
9.在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a
molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?) xC(g)ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是( )
xC(g)ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是( )
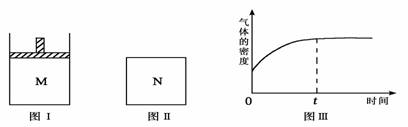
A.x =4
B.若N中气体的密度如图Ⅲ所示,则A、B是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
8.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是 ( )
A.该温度下加入等体积pH = 12的NaOH溶液可使该溶液恰好呈中性
B.由水电离出来的H+的浓度是1.0×10-10mol/L
C.加入NaHSO4晶体抑制了水的电离
D.该温度高于25℃
7.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 ( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
6.设NA为阿佛加德罗常数,下列叙述中正确的 ( )
A.标准状况下,22.4LCO2和O2混合气体中含有的氧原子数为NA
B.0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA
C.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数为2NA
D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
5.下列各组离子在溶液中能大量共存的、且此溶液既能与盐酸反应又能与烧碱反应的是( )
A.Na+、K+、SO42-、HCO3- B.AlO2-、OH-、Na+、K+
C.K+、NH4+、NO3-、Cl- D.NH4+、Fe2+、HSO4-、OH-
4.下列化学反应的离子方程式正确的是 ( )
A.往碳酸钡中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com