
题目列表(包括答案和解析)
14.在下列实验中,可能达不到目的的是
A.用金属钠与水或乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性 B.用铂(Pt)电极电解Cu(NO3)2 、AgNO3 混合溶液,比较铜和银的金属活泼性
C.检测等物质的量浓度H3PO4和 H2SO4的酸性强弱,比较磷和硫两元素非金属性
的强弱.
D.向无色溶液加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO42-
13.X、Y、Z、W均为短周期元素,它们在周期表中相应位置如右图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中错误的是
|
B.原子半径:W>Z>Y>X
C.W的最高价氧化物对应水化物的酸性较Z的强
D.四种元素的单质中,Z的熔、沸点最高
12.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,可连续使用一个月才充一次电。其电池反应为:
 2CH3OH+3O2+4OH-
2CO32-+6H2O,
2CH3OH+3O2+4OH-
2CO32-+6H2O,
下列说法中错误的是
A. 放电时CH3OH在负极参与反应
B. 充电时电解质溶液的pH逐渐减小
C. 放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O
D. 充电时每生成1 mol CH3OH转移6 mol电子
11.下列叙述中,不正确的是
A.0.1 mol•L-1 CH3COOH溶液加水稀释,n(H+)增大
B.0.2 mol•L-1盐酸与等体积0.05 mol•L-1 Ba(OH)2溶液混合后,溶液pH为1
C.向含等浓度的KCl和KI的混合溶液,滴加少量AgNO3溶液生成黄色沉淀,说明同温度下Ksp(AgCl)大于Ksp(AgI)
D.若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则
c(NH4HSO4) < c(NH4NO3) < c(NH4HCO3)
10.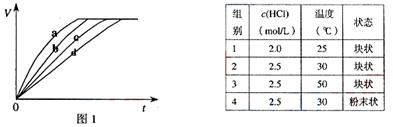 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是
① 4-3-2-1 ② 1-2-3-4 ③ 3-4-2-1 ④ 1-2-4-3
A. ①② B. ②③ C. ①③ D. ③④
9.已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的10 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
A. 该反应显示硫酸具有酸性
B. NH4CuSO3中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 反应中硫酸作氧化剂
8.下列离子方程式书写正确的是
A. 向NaOH溶液中通入足量SO2:SO2 + 2OH-= SO32- + H2O
B. 碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
C. SiO2溶于NaOH溶液:SiO2+2OH-=SiO32-+H2O
D. Fe2O3溶于过量的氢碘酸:Fe2O3+6H+=2Fe3++3H2O
7.NaHA是二元酸H2A的酸式盐,下列说法正确的是
A. 若NaHA的水溶液呈酸性,则二元酸H2A一定是强酸
B. 若NaHA的水溶液呈碱性,则HA-只发生水解
C. 无论H2A是强酸还是弱酸,NaHA溶液中Na+和HA-的个数之比都是1:1
D. 无论H2A是强酸还是弱酸,NaHA晶体中的阴阳离子个数比都是1:1
6.若溶液中由水电离产生的c(OH-)=1×10-14 mol/L,满足此条件的溶液中一定可以大量共存的离子组是
A. Al3+、Na+、NO3-、Cl- B. K+、Na+、Cl-、NO3-
C. K+、Na+、Cl-、Al(OH)4- D. K+、NH4+、SO42-、NO3-
5.欲在有Y存在的情况下,用一种试剂Z来检验盐溶液中的离子X,下表中对应的试剂Z合理的是
|
|
A |
B |
C |
D |
|
试剂Z |
氨水 |
硝酸银溶液 |
硫酸钠溶液 |
硝酸钡溶液 |
|
X |
Mg2+ |
Cl- |
Ba2+ |
SO42- |
|
Y |
Al3+ |
CO32- |
Mg2+ |
SO32- |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com