
题目列表(包括答案和解析)
3.下列仪器中,能用于直接加热的是
A.烧杯 B.试管 C.烧瓶 D.锥形瓶
2.当光束通过下列分散系时,能观察到丁达尔效应的是
A.盐酸 B.NaCl溶液 C.油水混合物 D.Fe(OH)3胶体
1.大气污染已成为人类社会面临的重大威胁。下列气体不会造成大气污染的是
A.N2
B.C12 C.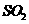 D.
D.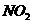
21.(15分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:查阅资料
Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加
KSCN 试剂
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 )
。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的离子方程式
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuSO4 . 5H2O)。经查阅资料得知 ,在溶液中通过调节溶液的酸碱性而使Cu2 +、Fe2+、Fe3+分别生成沉淀的pH 如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:
A. 氯水 B. H2O2 C. NaOH D. Cu2(OH)2CO3
实验小组设计如下图实验方案:
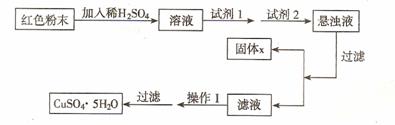
试回答:试剂I为 ,试剂II为 (填字母)操作 I 的名称为_________
期末联考化学试题


20.(12分)已知a、e、H为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
e |
H |
|
原子核数 |
单核 |
两核 |
四核 |
|
粒子的电荷数 |
一个单位正电荷 |
一个单位负电荷 |
0 |
(1)请写出H的电子式 ____________
物质A由a、e 构成,B、C、D都是单质,各有关物质之间的相互反应转化关系如图所示,反应①-⑥是用于工业生产的反应
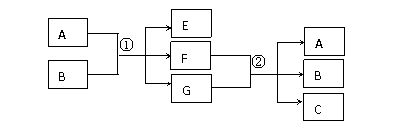
(2)写出②反应的离子反应方程式:______________________________________ 。
(3)反应②用于工业生产时为了防止B和C混合反应产生危险,能保证B和C不接触,所使用的一种特殊材料的名称为 ________________________ 。
(4)实验室模拟工业反应②的过程如图所示,标况下,当电极上产生112mL B气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=
______________ 
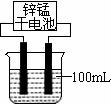 下图中C、D单质可以发生如下一系列反应,I和J的相对分子质量之差为16,K是重要的化工原料。
下图中C、D单质可以发生如下一系列反应,I和J的相对分子质量之差为16,K是重要的化工原料。
(5)在工业生产中,1mol H最终转化为1 mol K时,转移电子的物质的量为___________。
(6)E(溶液)能与H以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到稀有气体的稳定结构,则N的分子式为 _______________
19.(13分)现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法
反应物的转化率不高。
(1)合成氨反应的化学方程式为1N2(g)+3H2(g) 2NH3(g),在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率为:
。反应的化学平衡常数K=
若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
2NH3(g),在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率为:
。反应的化学平衡常数K=
若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
(任意写一条)。
(2)在上述平衡中,若再加入2 mol NH3、2 mol N2,则此时反应平衡将_________移动。(填“向正方向”、“向逆方向”或“不”)。
(3)已知:0.01mol/L氨水溶液50ml与同浓度同体积的盐酸混合,则溶液中各离子浓度的大小为: 。若再往混合溶液中再加入0.01mol/L氨水溶液50ml,c(Cl-)-c(NH4+)=______________;(用溶液中微粒浓度表示等式)
(4)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.8 kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
氨催化氧化生成NO和水的热化学方程式为

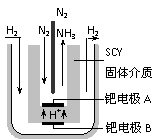 (5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)
请回答:在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。钯电极A是电解池的 极(填“阳”或“阴”),该极上的电应式是 。
18.(9分)有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3- ,取该溶液进行实验:
|
实验步骤 |
实验现象 |
|
(1)取少量该溶液,测定溶液pH |
pH=0 |
|
(2)取少量该溶液加热浓缩,加Cu片和浓 H2SO4 ,加热 |
有无色气体产生,气体遇空气变成红棕色 |
|
(3)取少量该溶液,加少量BaCl2溶液 |
有白色沉淀 |
|
(4)取(3)中上层清液,加足量AgNO3溶液 |
有白色沉淀,且不溶于稀HNO3 |
|
(5)取少量该溶液,加NaOH溶液 |
有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有 ,
溶液中肯定存在的离子是 。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)
17.将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol·L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
A. 5.52g B.(m+6.8)g
C.(m+2.55)g D.(m+12.0)g
第Ⅱ卷(共49分)
16.H2CO3和H2S在25℃时的电离常数如下:
|
电离常数 |
Ka1 |
Ka2 |
|
H2CO3 |
4.2×10-7 |
5.6×10-11 |
|
H2S |
5.7×10-8 |
1.2×10-15 |
则下列判断正确的是
A. NaHCO3+NaHS=Na2CO3+H2S反应可能发生
B. H2S+Na2CO3=NaHS+NaHCO3 反应不可能发生
C. 将Na2S溶液适当加热(忽略水的蒸发),溶液中阴离子数目会增多
D. Na2CO3溶液中:C(Na+)+C(H+)=C(CO32-)+ C(HCO3-)+C(OH-)
15.用于净化汽车尾气的反应:2NO(g)+2CO(g) 2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
A. 装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B. 提高尾气净化效率的常用方法是升高温度
C. 提高尾气净化效率的最佳途径是研制高效催化剂
D. 570K时该反应正向进行的程度很大,故使用催化剂并无实际意义
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com