
题目列表(包括答案和解析)
1.如右图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。
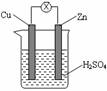 下列叙述正确的是( )
下列叙述正确的是( )
A.Zn是负极,发生还原反应
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.该装置将化学能转变为电能
31.用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
|
实验次数 |
称取样品的质量/g |
所加Ba(OH)2溶液的体积/L |
测得生成沉淀质量/g |
|
1 |
0.858 |
0.5 |
1.379 |
|
2 |
1.716 |
0.5 |
|
|
3 |
2.574 |
0.5 |
4.137 |
|
4 |
3.432 |
0.5 |
5.516 |
|
5 |
4.290 |
0.5 |
5.516 |
|
6 |
5.148 |
0.5 |
5.516 |
回答下列问题:
(1)写出少量NaHCO3和过量Ba(OH)2溶液反应的离子方程式:
___ HCO3-+Ba2++OH-→BaCO3↓+H2O ____;
(2)第2次实验中产生沉淀质量是_____2.758_____g,
(3)样品中NaHCO3和K2CO3的物质的量之比是____2∶5_____;
(4)原Ba(OH)2溶液的浓度为_____0.056 _____mol/L;
(5)室温下取第3组实验所得溶液体积的1/10,加水配成500mL溶液,则稀释以后溶液的pH为__12____。
30.将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加 入50mL1mol·L-1的盐酸,可恰好使反应过程中产生的沉淀刚好消失。求原混合物中铝、过氧化钠各多少克?
解析:Al-Na2O2在水中发生的反应分别为2Na2O2+2H2O=4NaOH+O2↑和2Al+2NaOH+2 H2O=2NaAlO2+3H2↑,加入盐酸后又发生了反应NaOH+HCl==NaCl+H2O、NaAlO2+HCl+H2O=Al(OH)3↓+NaCl、Al(OH)3+3HCl=AlCl3+3H2O,可见,最后 所得溶液中的溶质是NaCl和AlCl3。综合上述五个化学方程式可得如下关系式:Al-NaAlO2-Al(OH)3-AlCl3-3HCl,Na2O2-2NaOH-2NaCl-2HCl,设原混合物中xmolAl, 有ymolNa2O2,则依关系式
Al - 3HCl Na2O2 -2HCl
x 3x y 2y
和题给数据可建立等式27x+78y=1.05(①式)和3x+2y=1×50×10-3(②式),联立①②两式并解之,x=y=0.01(mol),进而可知Al的质量为0.01×27=0.27(g),Na2O2的质量为0 .01×78=0.78(g)
29.根据图示回答下列问题:
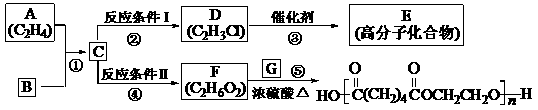
(1) 写出A、E、G的结构简式:
A___ CH2=CH2___, E__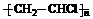 ___, G__ HOOC(CH2)4COOH __;
___, G__ HOOC(CH2)4COOH __;
(2) 反应②的化学方程式(包括反应条件)是:
___ ClCH2CH2Cl+NaOH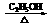 CH2=CHCl+NaCl+H2O ___,
CH2=CHCl+NaCl+H2O ___,
反应④化学方程式(包括反应条件)是:
ClCH2CH2Cl+2NaOH(aq) HOCH2CH2OH+2NaCl;
HOCH2CH2OH+2NaCl;
(3) 写出①、⑤的反应类型:①___加成反应__、⑤___缩聚反应___。
28.某烃类化合物A的相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为 (CH3)2C=C(CH3)2 ;
(2)A中的碳原子是否都处于同一平面? 是 (填“是”或者“不是”);
(3)在下图中,D1 、D2互为同分异构体,E1 、E2互为同分异构体。

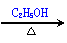 反应②的化学方程式为:
反应②的化学方程式为:
(CH3)2CClCCl(CH3)2 +2NaOH CH2=C(CH3)C(CH3)=CH2 +2NaCl+2H2O ;
C的化学名称为 2,3-二甲基-1,3-丁二烯 ;
E2的结构简式是 CH2(OH)C(CH3)=C(CH3)CH2(OH) ;
④、⑥的反应类型依次是 
 加成 、 取代 。
加成 、 取代 。
27.工业制备高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
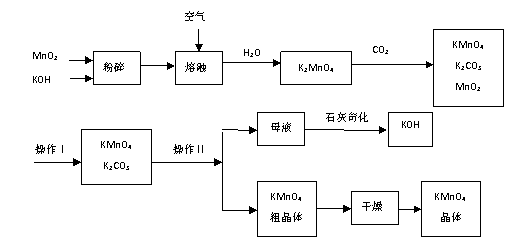

①KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_ ab _(填代号,下同)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
②高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是___ d __。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
③上述流程中可以循环使用的物质有 MnO2 、 KOH (写化学式)。
④若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 2/3 mol KMnO4。
⑤该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号) cd 。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
⑥操作Ⅰ的名称是 过滤 ;操作Ⅱ根据KMnO4和K2CO3两物质在 溶解度 (填性质)上的差异,采用 浓缩结晶 (填操作步骤)、趁热过滤得到KMnO4粗晶体。;;
26.我国化学家侯德榜改革国外的Na2CO3生产工艺,创造了侯氏制碱法,又叫联碱法,该法是将合成氨工厂生产的NH3及副产品CO2,通入到饱和食盐水中得到NaHCO3,分离出的NaHCO3加热制得Na2CO3。某研究性学习小组设计如下图所示的模拟装置,该装置可实现部分原料的循环使用。
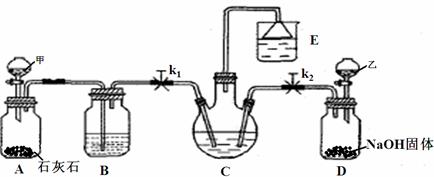 (1)分液漏斗甲中为盐酸,装置B中试剂为 饱和NaHCO3溶液 ,分液漏斗乙中是易挥发的某试剂,该试剂为 浓氨水 。
(1)分液漏斗甲中为盐酸,装置B中试剂为 饱和NaHCO3溶液 ,分液漏斗乙中是易挥发的某试剂,该试剂为 浓氨水 。
(2)实验操作过程中,应先打开 k2 (填“k1”或“k2”),当观察到 E中漏斗有液面上升时 现象时,再打开另一个弹簧夹。
(3)装置E中试剂为饱和NaCl溶液,该装置能体现绿色化学思想的两个作用是 吸收氨气防止污染 、 获得NaCl和氨水的饱和液循环使用 。
(4)老师认为在C、D之间还应增加一个装置,该装置作用为 防止倒吸 。
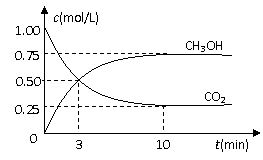
25.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)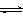 CH3OH(g)+H2O(g) +49.0kJ
CH3OH(g)+H2O(g) +49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
① 从反应开始到平衡,氢气的平均反应速率v(H2)=__0.225__mol/(L·min)。
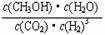
② 该反应的平衡常数表达式为__K=__ 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是__ C、D ____。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
④ 下列说法正确是 C D
A、反应进行到3min时达到平衡 B、只有平衡时3C(CO2)=C(H2)
C、反应进行到3min时C(CH3OH)=C(CO2) D、1mol CO2和3mol H2反应达到平衡时放热36.75kJ
24.二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。某研究小组设计如图所示实验制备ClO2。
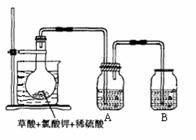 (1) 如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为:
(1) 如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为:
2KClO3+ H2C2O4+2H2SO4 →2ClO2+2CO2+2KHSO4+2H2O,
氧化产物与还原产物的物质的量之比为 1:1 。
(2) 控制水浴温度在60-80℃之间的目的是 使反应正常进行,并防止温度过高引起爆炸 ,图示装置中缺少的一种必须的玻璃仪器是 温度计 。
(3) A装置用于吸收产生的二氧化氯,其中最好盛放 ② 。(填序号)
①60 ℃的温水 ②冰水 ③饱和食盐水
(4) 将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量用稀硝酸酸化过的氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式:
5H2S+8ClO2+4H2O→5SO42-+8Cl-+18H+
23.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
⑴ ④、⑤、⑥的原子半径由大到小的顺序为 Na>Al>O 。
⑵ ⑤、⑥、⑧的相应的离子半径由大到小的顺序为 Cl->Na+>Al3+ 。
⑶ ②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 HNO3>H2CO3>H2SiO3 。
⑷ 用多孔石墨电极电解滴有酚酞的元素⑤和元素⑧形成的化合物的饱和溶液,接通电源一段时间后, 阴 极(填电极名称)附近出现红色,另一极的电极反应式为 2Cl- -2e→Cl2↑ ,可用 湿润的KI-淀粉试纸 检验该电极所得产物。
 ⑸
由①和②两种元素形成的相对分子质量为44的化合物的燃烧热为2220KJ/mol,
⑸
由①和②两种元素形成的相对分子质量为44的化合物的燃烧热为2220KJ/mol,
请写出其热化学方程式: C3H8(g)+5O2(g) 3CO2(g)+4H2O(l)+2220KJ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com