
题目列表(包括答案和解析)
4、A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲、乙两种元素的原子个数比分别为1︰1和1︰2,高温煅烧A、B时,产物都是C(固体)和D(气体)。由D可制得E(酸)。E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入氢氧化钠溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白:
(1)A的化学式(分子式)是 ;
(2)B煅烧生成C和D的化学方程式是 ;
甲元素的单质与F溶液反应的离子方程式是 ;
(3)往G溶液中加入NaOH溶液发生的现象是 ;
3、右图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)
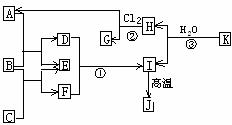 请按要求回答:
请按要求回答:
(1)写出B的化学式_____________________,G的电子式______________________。
(2)反应①的离子方程式为___________________________________。
(3)反应②进行的条件是______________、____________。
(4)反应③的化学方程式为____________________________________。
2、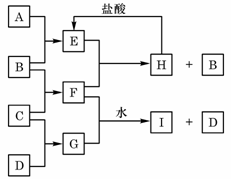 A、B、C、D是按原子序数由小到大排列的第二、
A、B、C、D是按原子序数由小到大排列的第二、
三周期元素的单质。B、E均为组成空气的成分。
F的焰色反应呈黄色。在G中,非金属元素与金
属元素的原子个数比为1∶2。在一定条件下,各
物质之间的相互转化关系如右(图中部分产物未列
出):
请填写下列空白:
(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
1、X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应: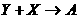 (气),
(气),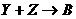 (气)。请针对以下两种不同情况回答:
(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
<1>Y的化学式是_________;
<2>生成固体C的化学方程式是_______________________________________。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
<1>B的化学式是__________;
<2>向苛性钠溶液中通入过量的A,所发生反应的离子方程式是
_____________________________________________;
<3>将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
21.(《物质结构与性质》)
(1)金属镁有许多重要的用途,法国化学家维多克·格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如下图:
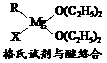
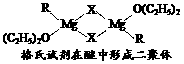
①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出。
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为_________;Mg
原子的核外电子排布式可表示为________________________。
③下列比较中正确的是_________________________________
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:NaCl>MgCl2
|
TiCl4+2Mg=======Ti+2MgCl2
①Ti元素在元素周期表中的位置是 ,钛原子的外围电子排布式为 。
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于 (填“原子”、“分子”或“离子”)晶体。
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
A. 苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
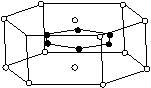 (3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录。下图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录。下图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
A.MgB B.MgB2 C.Mg2B D.Mg3B2
20.某自来水中含有Ca2+、Mg2+、Na+、K+、HCO3-、SO42-、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据为
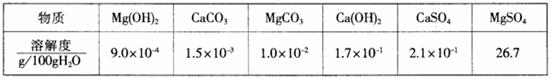
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因 。
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是 (填序号)。
A.NaCl B. NaOH C.Na2CO3 D.Na2S
CaSO4能转化为物质Y 的原因是(用文字叙述) 。
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式) 。
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是 。
19.相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
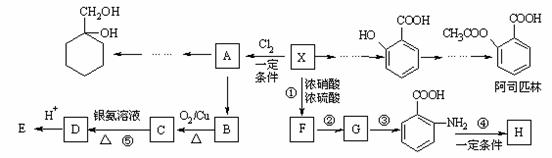
已知:
Ⅰ 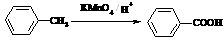
Ⅱ 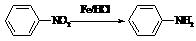 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
⑴H的结构简式是_______________________________________________;
⑵反应②的类型是 ;
⑶反应⑤的化学方程式是____________________________________________;
⑷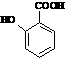 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有_____种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有_____种;
⑸请用合成反应流程图表示出由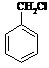 和其他无机物合成
和其他无机物合成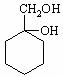 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。
 例:
例:

18.(10分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍。因此,必须对含铬的废水进行处理。目前研究和采用的处理方法主要有:
 方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下:
方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下:
有关离子完全沉淀的p H如下表。
|
|
Fe(OH)2 |
Fe(OH)3 |
Cr(OH)3 |
|
Ksp |
8.0×10-16 |
4.0×10-38 |
6.0×10-31 |
|
完全沉淀的pH |
9.0 |
3.2 |
5.6 |
请回答下列问题:
(1)在②中调节pH的范围至 为最好。(填序号)
A.3-4 B.6-8 C.10-11 D.12-14
(2)若在①使FeSO4适当过量、空气适量,使Fe2+与Fe3+的比例恰当时,可产生具有磁性、组成类似于Fe3O4•xH2O的铁氧体悬浮物,变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。
方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(3)写出此阴极反应的电极方程式 。现用上法处理1×104 L含铬(+6价)78 mg / L的废水,电解时阳极物质消耗的质量至少为________kg。
17.(10分)下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
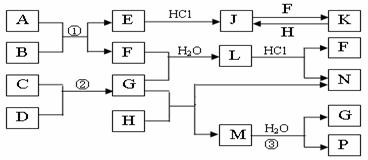
已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)F的化学式 ;G的水溶液中,最多的阳离子是
(2)写出K与H反应的离子方程式
G与H反应的化学方程式
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释 。
16.(10分) 随着经济发展和人民生活水平的提高,近年来我省汽车拥有量呈较快增长趋势。
⑴ 乙丙橡胶(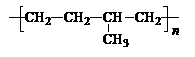 )因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
)因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
(2) 在发动机和三元催化转化器间的尾气流中安装一个称为λ探测器的电化学元件,可测定λ(λ=入口处的空气量/完全燃烧需要的空气量)值,如右图所示。当汽车速度增加时,入口处的空气量增大,此时排出尾气中的主要污染物是 。在转化器的前半部,一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体,其反应的化学方程式为 。
(3)测定汽车尾气中NO,NO2的方法之一,用3%的H2O2溶液吸收生成HNO3,再用NaOH标准溶液滴定。若要确定尾气中NO,NO2体积分数总和,所需的数据有___________(选填序号)。
A.气体样品的体积
B.NaOH标准溶液的浓度及所消耗的体积
C.从滴定开始到指示剂变色所需的时间
D.两种氮氧化物的体积比
(4)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。写出用合成气(CO和H2)生产甲醇的化学方程式__________________________,用该方法合成甲醇的最大优点是______________________________________________。已知甲醇燃烧热为726kJ/mol。请写出甲醇燃烧的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com