
题目列表(包括答案和解析)
4、在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气密度的8倍,这是测得容器内的压强为p1.若控制容器的体积不变,加入足量的Na2O2,充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器的压强为p2。则p1和p2之间的关系是 ( )
A、p1= 8 p2 B、p1= 4 p2 C、p1= 2 p2 D、p1= p2
3、等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为 ( )
A. 3∶4∶1 B. 3∶3∶2 C. 6∶7∶3 D. 6∶9∶0
2、一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是 ( )
①H2 ②CO ③CO和H2的混合物 ④HCOOCH3 ⑤CH3CHO
A、⑤ B、①② C、①②③④ D、①②③④⑤
1、某溶液中含有HCO3-、SO32-、CO32-、CH3COO- 4种阴离子。向其中加入过量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假定溶液体积无变化) ( )
A、HCO3- B、SO32- C、CO32- D、CH3COO-
17.同学们利用右下图装置探究SO2与Na2O2的反应。
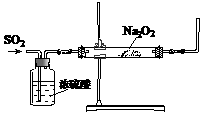 (1)同学们认为该反应类似CO2与Na2O2的反应有氧气生成,当通入气体后,如果把带火星的木条伸到导管口,预期现象为带火星的木条复燃。可是,当他们把带火星的木条伸到导管口后,木条并没有复燃,你分析其原因是
,改进的方法是 。
(1)同学们认为该反应类似CO2与Na2O2的反应有氧气生成,当通入气体后,如果把带火星的木条伸到导管口,预期现象为带火星的木条复燃。可是,当他们把带火星的木条伸到导管口后,木条并没有复燃,你分析其原因是
,改进的方法是 。
(2)反应完毕后,硬质玻璃管中的固体变为白色。大家认为固体成分有多种可能:
假设Ⅰ:全部为Na2SO3; 假设Ⅱ:为Na2SO3和Na2O2 的混合物;
假设Ⅲ: ; 假设Ⅳ:为Na2SO3 和Na2SO4的混合物;
假设Ⅴ:为Na2O2和Na2SO4的混合物。
假设Ⅲ、Ⅳ、Ⅴ的共同理由是 。
(3)现有下列实验用品:几支试管、带胶塞的导管(单孔)、滴管、药匙、品红溶液、蒸馏水、Ba(NO3)2溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝酸、浓硫酸、浓盐酸、浓硝酸,请你从中选出合适的用品对“假设Ⅳ”进行验证,完成下表(可以不填满):
|
实验步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
,用药匙取少量白色固体于试管中。 |
|
|
② |
向①的试管中加入
,塞紧带导管的胶塞,并将导管
。 |
|
|
③ |
|
|
|
④ |
|
|
16.平达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式碳酸盐,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g。试通过计算推测该碱式盐的化学式。
15.某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行)
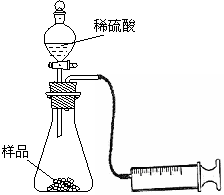 (3)打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为VmL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x+y=VmL/22400mL·mol-1,他们依据的原理是_________。根据相似原理,请完成下列算式:2x+y=__________。由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
(3)打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为VmL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x+y=VmL/22400mL·mol-1,他们依据的原理是_________。根据相似原理,请完成下列算式:2x+y=__________。由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
13.工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下:
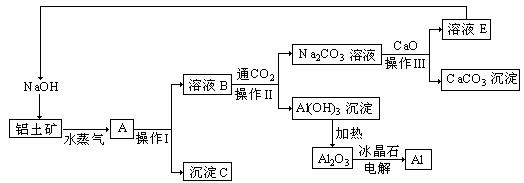
请回答下列问题:
(1)水蒸气的作用 。
(2)沉淀C的化学式为________,该物质除了用于金属冶炼以外,还可用作________。
(3)操作I、操作II、操作III都用到的玻璃仪器是有________________。
(4)实验室洗涤Al(OH)3沉淀应该如何操作: 。
(5)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
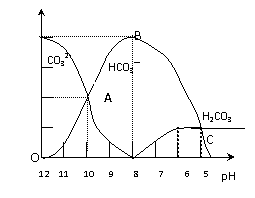
12.常温下在20mL0.1mol/LNa2CO3
溶液中逐滴加入0.1mol/L HCl溶液40mL,
溶液的pH逐渐降低,此时溶液中含碳元
素的微粒物质的量浓度的百分含量(纵轴)
也发生变化(CO2因逸出未画出),如下
图所示。回答下列问题:
(1)20mL 0.1mol/LNa2CO3溶液呈碱性的原因是
(用离子方程式表示): ;
其溶液中所有阳离子和阴离子的浓度有何关系?
(用等式表示) 。
(2)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
。
(3)当加入盐酸使溶液PH为10时,混合液中含碳元素的离子有哪些? ,其物质的量之比为 。 高 考 资 源 网
(4)请写出OAB段的离子方程式 ;
当混合液的pH= 时,开始放出CO2气体。
11.某化学研究性学习小组在研讨Fe3+和SO32-之间发生的反应时形成了两种观点。一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生水解反应:2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑。为了验证这两种观点的正确性,同学们设计并实施了下列实验,请你参与并协助完成相关学习任务。 高 考 资 源 网
[实验探究]
(1)先向试管中注入3mL Na2SO3浓溶液,然后加入少量BaCl2溶液,有白色沉淀生成,再加入少量稀盐酸,生成的沉淀完全溶解并有无色气体产生。这一实验目的是__________ 。 高 考 资 源 网
(2)向试管中加入3mL FeCl3浓溶液,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液,溶液颜色加深,最终变为红褐色(整个过程中无气体或沉淀产生)。向该红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是____________________;此时,再向试管中加入BaCl2溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式_______________。
(3)将FeCl3浓溶液和Na2SO3浓溶液稀释后重复实验(2)的操作。实验现象基本相同。由上述实验可以得出的结论是___________________。 高 考 资 源 网
[问题讨论]
(4)如果在FeCl3浓溶液中加入Na2CO3浓溶液,能观察到生成红褐色沉淀和无色气体的现象,该反应的离子方程式是_________________。
 (5)Na2SO3和Na2CO3分别与氯化铁溶液反应的现象不同,可能的原因是____________。
(5)Na2SO3和Na2CO3分别与氯化铁溶液反应的现象不同,可能的原因是____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com