
题目列表(包括答案和解析)
1、(2008·苏锡常镇情况调查二)二茂铁[(C5H5)2
Fe]是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展。二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得:2C5H6+Fe(还原铁粉)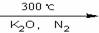 (C5H5)2
Fe+H2。请回答下列问题:
(C5H5)2
Fe+H2。请回答下列问题:
(1)写出二价铁离子的基态电子排布式: ;
(2)二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为 晶体,由此可进一步推知,在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是 ;
(3)环戊二烯的结构式为: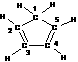 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),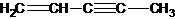 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有
个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有
个;
(4)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与N2分子互为等电子体的二价阴离子是 (填化学式),其电子式是 。
13、(南京市2008-2009学年度第一学期期末调研)铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
(1)铬原子的基态电子排布式为 。
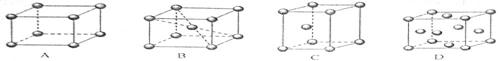
(2)金属铬的堆积方式属于钾型,其晶胞示意图为 (填序号)。
(3)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5℃,沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。①固态CrO2Cl2属于 晶体;②丙酮中碳原子采取的杂化方式为 ;③CS2属于 (填“极性”或“非极性”)分子;④CCl4分子空间构型为 。
(4)+3价的配合物K[Cr(C2O4)2(H2O)2]中,配体是 ,与C2O42 -互为等电子体的分子是(填化学式) 。
(5)CrCl3·6H2O(相对分子质量为266.5)有三种不同颜色的异构体:[Cr(H2O)6]Cl3、[Cr(H2O)5Cl]Cl2·H2O和[Cr(H2O)4Cl2]Cl·2H2O。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665 g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为 (填化学式)。
江苏省东台市五烈镇中学2010届高三化学周练
12、有机物结构可用“键线式”表示。如CH3-CH2-CH2-COOH可表示为: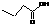 卡托普列(Captopril)临床用于治疗高血压和充血性心力衰竭。它最有价值的合成路线为:
卡托普列(Captopril)临床用于治疗高血压和充血性心力衰竭。它最有价值的合成路线为:
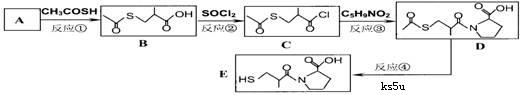
已知A的相对分子质量不超过100,它与Na或Na2CO3反应都能产生无色气体,还能使Br2/CCl4溶液褪色,A完全燃烧只生成CO2和H2O。
核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。A的核磁共振氢谱如下图:

试完成下列问题
(1)A的结构简式为:____________ ;反应②的反应类型是_________
(2)上图反应中,符合绿色化学思想(原子利用率100%)的是第______ 步(填反应序号)
(3)已知反应③为取代反应,则C5H9NO2的结构简式为: ________
(4)A的甲醇酯是合成有机玻璃的单体,写出合成有机玻璃的化学方程式:_______________
(5)已知羧基(-COOH)pKa=3.7,巯基(-SH)pKa=9.8,H2O的pKa=16,pKa越小,酸性越强,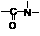 能在碱性条件下水解。则1molE最多能与_____molNaOH完全反应。(Ka是平衡常数,pKa= -lgKa)
能在碱性条件下水解。则1molE最多能与_____molNaOH完全反应。(Ka是平衡常数,pKa= -lgKa)
11、将a molNa2O2和bmolNaHCO3混合置于密闭容器中,加热至300℃使其充分反应。回答下列问题:
(1)当剩余固体为Na2CO3,排出气体为O2和H2O(g)时,a/b= 。
(2) 当剩余固体为Na2CO3和NaOH,排出气体为O2和H2O(g)时,a/b间的关系为 。
(3) 当a/b>1时,剩余固体为 ,排出气体为 ;
(4)当排出的O2和H2O(g)为等物质的量时,a/b= 。
10、向某NaOH溶液中通人CO2气体后得溶液M,因CO2通人量的不同,溶液M的组成也不同。若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是(不计CO2的溶解) ( )
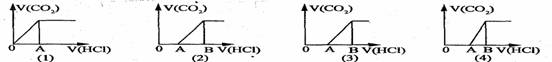
A、M中只有一种溶质的有(1)和(3) B、M中有两种溶质的有(2)和(4)
C、(2)图显示M中c(NaHCO3)>c(Na2CO3) D、(4)图显示M中c(NaHCO3)>c(Na2CO3)
9、下列三种有机物是某些药物中的有效成分:
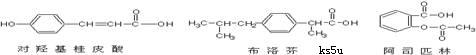
以下说法正确的是 ( )
A.三种有机物都属于芳香烃化合物
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将各1mol的三种物质分别与氢氧化钠溶液充分反应,阿司匹林消耗氢氧化钠最多
D.三种有机物都能与浓溴水发生反应
8、把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比及原稀盐酸的物质的量浓度可能是 ( AD )
|
|
A |
B |
C |
D |
|
Na2O2和NaHCO3的物质的量之比 |
8﹕1 |
9﹕2 |
1﹕8 |
2﹕9 |
|
原稀盐酸的物质的量浓度(mol/L) |
3.4 |
1.1 |
1.8 |
1.3 |
7、短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、Z在同一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是 ( )
A.离子半径:Y>X B.气态氢化物的稳定性:Z>X
C.Y的氧化物中含有离子键 D.Z的氧化物对应的水化物是弱碱
6、①将0.100L 1.00mol/L的纯碱溶液逐滴滴入0.100L 1.25mol/L的盐酸中;②将0.100L 1.25mol/L的盐酸逐滴滴入0.100 1.00mol/L的纯碱溶液中,两种操作产生CO2的体积比为 ( )
A、2:1 B、2:5 C、5:2 D、1:1
5、设NA代表阿伏加德罗常数的数值,下列说法中正确的是 ( )
①常温常压下,8 g甲烷(12CH4)所含的中子数为5NA
②常温常压下,22.4 L N2气体的分子数小于NA
③64 g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,0.5 mol/L的乙酸溶液中,乙酸的分子数目略小于0.05NA
⑤标准状况时,22.4 L 氧单质中氧原子数可能为2.5 NA
⑥常温常压下,1mol氦气分子含有的核外电子数为4NA
A.①② B.③④ C.②⑤ D.⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com