
题目列表(包括答案和解析)
1、(2008·南通二调)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 (1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
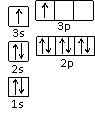
①某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了 。
 ②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
10、(2008·泰州3月)A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:

(1)写出F的基态原子核外电子排布式:__________________。
(2)C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是____ __。
 (3)由A、B、D三种元素形成的一种物质俗称光气,分子中A原子采取sp2杂化成键。光气分子的结构式是___________,其中碳氧原子之间共价键是_____(填序号):
(3)由A、B、D三种元素形成的一种物质俗称光气,分子中A原子采取sp2杂化成键。光气分子的结构式是___________,其中碳氧原子之间共价键是_____(填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
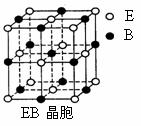
(4)EB晶胞如右图所示,EB晶体中E2+的配位数为_____,EB晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:EB-3401kJ/mol、NaCl-786kJ/mol。导致两者晶格能差异的主要原因是_______________________________________________。
(5)现有含F的两种颜色的晶体,一种为紫色,另一为绿色,它们都是配位数为6的配合物(配离子难电离)。相关实验证明,两种晶体的组成皆为FD3·6H2O。为测定这两种晶体的化学式,取等质量的两种晶体分别配成待测溶液,各滴入足量的AgNO3(aq),原绿色晶体的水溶液得到白色沉淀的质量为紫色晶体的水溶液得到白色沉淀质量的2/3 。则紫色晶体配合物的化学式为________________,绿色晶体中含有化学键类型是 。
江苏省东台市五烈镇中学2010届高三化学周练
9、(2008·徐州三调)

8、(2008·苏北四三市三调)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
A |
|
|
|
|||||||||
|
|
|
B |
|
|
C |
|
|
||||||||||
|
|
|
|
|
|
|
D |
E |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素D的基态原子电子排布式 ;
(2)D、E两元素的部分电离能数据列于下表:
|
元 素 |
D |
E |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态D2+再失去一个电子比气态E2+再失去一个电子难。对此,你的解释是 ;
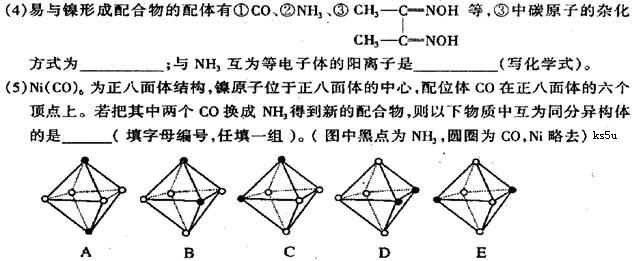
 (3)A的氢化物的中心原子的杂化形式为 ;C在空气中燃烧产物的分子构型为 ,与其互为等电子体的单质的分子式为 。
(3)A的氢化物的中心原子的杂化形式为 ;C在空气中燃烧产物的分子构型为 ,与其互为等电子体的单质的分子式为 。
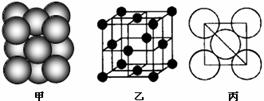
(4)B单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为 。
7、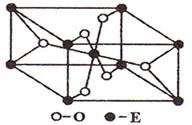 (苏北四市2008--2009学年度高三年级第四次调研)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂。E有“生物金属”之称,E
(苏北四市2008--2009学年度高三年级第四次调研)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂。E有“生物金属”之称,E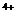 离子和氩原子的核外电子排布相同。请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
离子和氩原子的核外电子排布相同。请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为 。
(2)下列叙述正确的是 。(填字母)
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个 键和1个
键和1个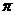 键
键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧的配位数为 。
(4)电镀厂排放的废水中常含有剧毒的BC--离子,可在Q的催化下,先用NaClO将BC--氧化成BCD--,再在酸性条件下BCD--继续被NaClO氧化成C2和BD2。
① A、B、C、D四种元素的电负性由小到大的顺序为 。
② 与BCD--互为等电子体的分子、离子的化学式依次为 (各写1种)。
③ 上述反应中后一步反应的离子方程式是 。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3·6H20的绿色晶体,该晶体中两配体的物质的量之比为1:5,则该配离子的化学式为 。
6、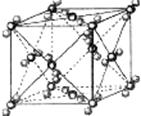 (苏北四市2008--2009学年度高三年级第二次调研)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中B、D、E原子最外电子层的P能级(轨道)上的电子处于半满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示。原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近lO年迅速发展起来的第三代新型半导体材料。试回答下列问题: (答题时,A、B、C、D、E用所对应的元素符号表示)
(苏北四市2008--2009学年度高三年级第二次调研)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中B、D、E原子最外电子层的P能级(轨道)上的电子处于半满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示。原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近lO年迅速发展起来的第三代新型半导体材料。试回答下列问题: (答题时,A、B、C、D、E用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为 。
(2)A、B、C的第一电离能由大到小的顺序为 。
(3)B元素的单质分子中有 个π键,与其互为等电子体的物质的化学式可能为 (任写一种)。
(4)上述A的氧化物分子中心原子采取--杂化,其晶胞中微粒问的作用力为 。
(5)EH3分子的空间构型为 ,其沸点与BH3相比 (填“高”或“低”),原因是 。
(6)向CuS04溶液中逐滴加入BH3的水溶液,得到深蓝色的透明溶液。请写出该反应的离子方程式 。
5、(南京市2009届高三质量检测9月)锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)葡萄糖酸锌[CH2OH(CHOH4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式是 。
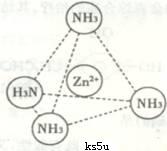
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子空间构型为 ;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键 。
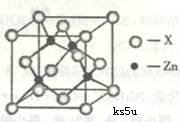
(3)上右图表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
4、(2009·海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。请回答:
(1)A元素的名称是 ;
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为 :
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
3、(2009·山东高考)G和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 。
从电负性角度分析C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号),MO是优良的耐高温材料,其品体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是 。
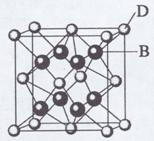 (4)C、Si为同一主族的元素,CO2和SiO2:化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成o键和a键,SiO2:中Si与O原子间不形成上述z健。从原子半径大小的佳都分析,为什么C、O原子间能形成,而S、O原子间不能形成上述π键。 。
(4)C、Si为同一主族的元素,CO2和SiO2:化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成o键和a键,SiO2:中Si与O原子间不形成上述z健。从原子半径大小的佳都分析,为什么C、O原子间能形成,而S、O原子间不能形成上述π键。 。
2、(2009·安徽高考)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的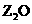 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比
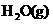 __________(填“强”或“弱”)。
__________(填“强”或“弱”)。
(2)Y的基态原子核 外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
_________________________________________________________________________。
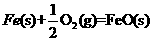
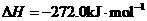
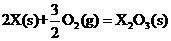
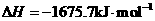
X的单质和FeO反应的热化学方程式是_________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com