
题目列表(包括答案和解析)
9. X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是( )
A.还原性:X的氢化物>Y的氢化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX2、M2Y都是含有极性键的极性分子
D.Z元素的最高价氧化物的水化物的化学式为HZO4
8.右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是 ( )
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
7.有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
第一组 He -268.8 (a) -249.5 Ar -185.8 Kr -151.7
第二组 F2 -187.0 Cl2 -33.6 (b) 58.7 I2 184.0
第三组 (c) 19.4 HCl -84.0 HBr -67.0 HI -35.3
第四组 H2O 100.0 H2S -60.2 (d) -42.0 H2Te -1.8
下列各项中正确的是( )
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
6.有关晶体的下列说法中正确的是 ( )
A. 分子晶体中分子间作用力越大,分子越稳定
B. 原子晶体中共价键越强,熔点越高
C. 冰熔化时水分子中共价键发生断裂
D. 氯化钠熔化时离子键未被破坏
5.除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( )
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
4.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
A.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
B.1 mol HCl气体中的粒子数与0.5 mol•L-1盐酸中溶质粒子数相等
C.在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10NA
D.CO和N2为等电子体,22.4 L的CO气体与1 mol N2所含的电子数相等
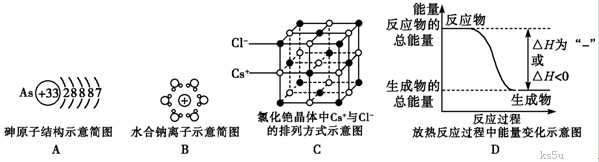
3.用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是 ( D )
2.在碱性条件下能够大量共存,而在强酸性条件下却能发生氧化还原反应的离子组是( )
A.Ca2+、AlO2-、SO42-、Cl- B.K+、Na+、ClO-、Cl-
C.Na+、Fe2+、NO3-、SO42- D.NH4+、Na+、F-、CO32-
1.下列说法正确的是( )
A.IA族元素的金属性一定比IIA族元素的金属性强
B.VIA族元素中氢化物最稳定的其沸点一定最高
C.非金属元素形成的化合物中只有共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减少
25.(14)某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质m mol,浓硫酸易和SO3形成H2SO4. SO3 , 假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
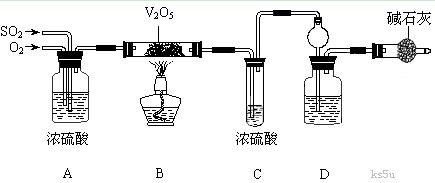
请回答下列问题:
(1)已知0.5 mol SO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为______________________________________________。
(2)检查完装置的气密性,加入药品开始实验,此时首先应进行的操作是________________。
(3)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是 ;装置C中浓硫酸的作用为 ;装置D中盛放的溶液是足量的 (选填字母)。
a. BaCl2溶液 b. NaOH溶液 c. NaHSO3饱和溶液
(4)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
26(12) 已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该氧化还原反应的体系中,还原剂是______,化合价没有发生变化的反应物是___ 。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):
________________________________________________________。
(3)上述反应中,1 mol氧化剂在反应中转移的电子为_______ mol。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3证明NaBiO3的一个性质是:_______________________________________。
|