
题目列表(包括答案和解析)
5.研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是
A.加入少量H2SO4使淀粉水解
B.碳酸钠与硫酸反应
C.向铜和双氧水的混合物中加入硫酸
D.潮湿的氯气通过盛有浓H2SO4的洗气瓶
4.A、B、C、D、E五种短周期元素,其原子序数逐渐增大。元素A的单质是密度最小的气体,元素B的单质存在两种以上同素异形体,且其中一种是自然界中硬度最大的单质,元素D的最外层电子数是次外层电子数的三倍。B、C、D、E四种元素均能与A形成电子数相等的四种分子,且化合物中各原子的个数比如下表:
|
化合物 |
甲 |
乙 |
丙 |
丁 |
|
原子个数比 |
B∶A=1∶3 |
C∶A=1∶2 |
D∶A=1∶1 |
E∶A=1∶1 |
下列说法正确的是
A.元素E在元素周期表中的位置为第二周期、VIIA族
B.原子半径:A<B<C<D
C.甲和丙分子均是含极性键和非极性键的非极性分子
D.A、B、C、D四种元素中的三种能形成多种与甲分子电子数相等的化合物
3.设NA为阿伏加德罗常数,下列有关说法正确的是
A.1molNH4NO3晶体中含有NH4+数为NA个
B.1molC20H42分子中含有的共价键数目为62NA
C.电解精炼铜过程中,电路中每通过NA个电子,阳极溶解铜32g
D. 标准状况下,2.24LCCl4和CH2O的混合物中含有NA个碳原子
2.下列文字表述与反应方程式对应且正确的是
A.溴乙烷的消去反应:CH3CH2Br C2H4↑ + HBr
C2H4↑ + HBr
B.FeO在空气中受热,迅速被氧化:6FeO + O2 2Fe3O4
2Fe3O4
C.粗硅的制取:SiO2 +
C Si
+ CO2
Si
+ CO2
D.示踪原子法研究乙酸与乙醇酯化反应:

1.据国外媒体报道,“火星快车”号和“金星快车”号探测器日前分别在火星和金星大气层中发现了一种非常特殊的气态化合物。这种化合物的存在不但会导致金星上的温室效应被成倍的放大,而且可能会在火星上也诱发温室效应的产生。它的结构式为:16O=C=18O)。下列说法正确的是
A.16O与18O为同种核素
B.16O=C=18O与16O=C=16O互为同位素
C.16O=C=18O的化学性质与16O=C=16O几乎相同
D.用 16O=C=18O与Na216O2反应生成的氧气中含18O
24.(12分)请你参与下列研究性学习活动:
I.研究性学习小组甲对教材中“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”的实验结论提出质疑,他们认为红色沉淀不一定是氧化亚铜,猜想是铜和氧化亚铜的混合物。
为了确定红色沉淀的成分,开展了如下研究:
查阅资料:
氧化亚铜属于碱性氧化物;+1价的铜离子在酸性条件下易发生自身氧化还原反应;在空气中灼烧氧化亚铜生成氧化铜。
设计实验方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣。
方案3:称取该红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至固体恒重,称得质量为bg,比较a与b关系。
方案4:取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色固体析出。
(1)通过分析,你认为合理的方案是 。
II.研究性学习小组乙针对小组甲的质疑,通过下图所示实验装置和实验步骤进行探究。
有关实验步骤:①通入氢气的体积;②反应前,红色沉淀+硬质玻管的总质量;③完全反应后红色固体+硬质玻管的总质量;④实验前,球形干燥管的质量;⑤硬质玻管的质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,球形干燥管的质量
(2)分析上述实验装置及步骤,你认为还应采取的措施是 (填序号)。
A.在氢气发生器与硬质玻璃管之间加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的球形干燥管后再连接一个装有碱石灰的干燥管
(3)检查上述装置气密性的方法是 (简要说明操作方法、现象和结论)。
(4)上述实验步骤中,通过步骤 (填序号)有关物理量的测定,就可确定红色沉淀成分。
III.研究性学习小组丙用“绿色化学”(强调环境友好,实现零排放)的思想,将上述收集的红色沉淀制备化学试剂--蓝矾(CuSO4•5H2O)。
(5)请你帮助他们设计一个简单且符合绿色化学要求的实验方案,用实验流程图表示,并注明必要的实验操作名称)。 。
23.某反应中反应物与生成物有: 、 、 、 、 、 和一种未知物质X。
(1)已知 在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2mol 在反应中得到1mol电子生成X,则X的化学式为 。
(3)根据上述反应可推知 。
a.氧化性: b.氧化性:
c.还原性: d.还原性:
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
向和数目:
22.海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
① ② ③ ……
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键
属于 键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按 、 、 、 的顺序由难变易
(4)卤素单质的键能大小如右图。由图推断:
①非金属性强的卤素,其单质分子的化学键
断裂(填“容易”或“不容易”或“不一定容易”)。
②卤素单质键能大小与键长的关系为:
21.化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质地电子式为 ;Z分子的结构呈 。 ②A的化学式是 。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是_________________________________________。
20.在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+ 、I-、NO3-
C.FeCl2溶液:K+、Na+、SO42 -、AlO2-
D.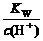 = 0.1 mol/L的溶液:Na+、K+、SiO32 -、NO3-
= 0.1 mol/L的溶液:Na+、K+、SiO32 -、NO3-
第Ⅱ卷(非选择题,共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com