
题目列表(包括答案和解析)
9.根据下表信息,判断以下叙述正确的是
|
短周期元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.M与T形成的化合物具有两性 B.单质与稀盐酸反应的速率为L<Q
C.氢化物的热稳定性为H2T<H2R D.氢化物的沸点为H2T<H2R
8. 设NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下的33.6L氯气与足量的铝充分反应,转移电子数为3NA
B.1L浓度为0.1mol·L-1的硫酸铜溶液中含铜离子数为0.lNA
C.0.lmol188O原子中含中子数为NA
D.4.6g NO2气体中含有的原子数为0.lNA
7.化学与生活密切相关,下列有关说法不正确的是
A.加热能杀死流感病毒是因为病毒的蛋白质受热变性
B.在汽车排气管上加装“催化转换器”是为了减少有害气体的排放
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.加碘食盐中主要添加的是碘酸钾
在进行实验时,造成的不良后果是 。
(2)为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作步骤。w.w.^w.k.s.5*
5.(15分)碳酸钠俗称纯碱,是一种常用化学品。工业上制取碳酸钠的方法是:将二氧化碳和氨气通入饱和食盐水中,控制一定温度,制得碳酸氢钠,再煅烧碳酸氢钠使其转化为碳酸钠。有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3
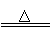 NH4HCO3+NaCl=NaHCO3↓+NH4Cl
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3 +CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水
B.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
C.碳酸氢钠受热易分解
(2)某探究活动小组根据工业制取碳酸钠的原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。w.w.^w.k.s.5*
i.乙装置中的试剂是 (填标号)。
A.烧碱溶液 B.澄清石灰水 C.浓氨水 D.蒸馏水
ii.丁装置的作用是 。
iii. 实验结束后,分离出NaHCO3晶体的操作是 (填名称)。
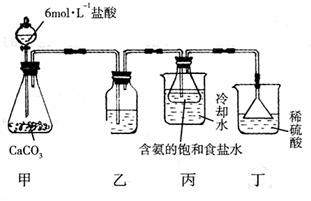
②另一位同学用下图中戊装置(其它装置未画出)进行实验。w.w.^w.k.s.5*
i. 实验时,须先从a管通入 气体,再从b管通入 气体。
ii. 有同学建议在b管下端连接上图中已装置,理由是
。
(3)请你再写出一种实验室制取少量碳酸氢钠的方法。w.w.^w.k.s.5*
I.实验装置如图1所示
(1)写出浓硝酸受热分解的化学方程式:w.w.^w.k.s.5*
;
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是
。
II.实验装置如图2所示:
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,试写出该反应的化学方程式: ;
(2)当集气瓶中充满红棕色气体时,余烬木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是
;
28. (14分)
次氯酸钠和高铁酸钾(
(14分)
次氯酸钠和高铁酸钾(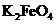 )是两种重要的化工产品,在生产和生活中有广泛的应用。
)是两种重要的化工产品,在生产和生活中有广泛的应用。
(1)工业上用氯气和烧碱溶液可以制取次氯酸钠,反应的离子方程式是 。
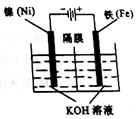
(2)工业上有多种方法制备高铁酸钾。
①电解法:原理如右图所示。阴极的电极反应是 。
②湿法氧化:在溶液中用次氯酸钠、氢氧化铁和氢氧化钾制高铁酸钾,参加反应的氧化剂和还原剂的物质的量之比是 。
(3)已知:
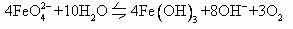
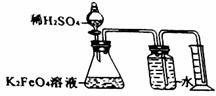
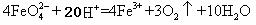
①配制高铁酸钾溶液时,应将其溶于一定浓度的KOH溶液中,原因是 。
②用如图所示装置测定高铁酸钾溶液中溶质的物质的量浓度,需要测定的两个实验数据是 。
(4)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,已知该电池的总反应是: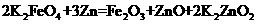 ,则负极的电极反应是
。
,则负极的电极反应是
。
27. (14分)工业以浓缩海水为原料提取溴的部分过程如下:
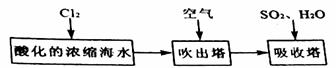
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
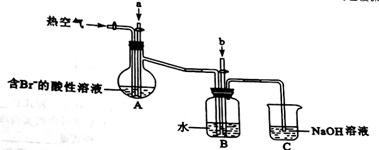
(1)A装置中通入a气体的目的是(用离子方程式表示) 。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是 。
(3)反应过程中,B装置中有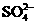 生成。检验
生成。检验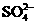 的方法是 。
的方法是 。
(4)C装置的作用是 。
(5)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。
①一位同学根据溴的沸点是59℃,提出采用 方法从该混合液中分离出溴单质。
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是 。
(6)某同学提出证明反应后B装置的溶液中含有溴离子的实验方案是:取出少量溶液,先加入新制氯水,再加入淀粉KI溶液。该方法是否合理并简述理由 。
26. (16分)有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NaOH、(NH4)2CO3、BaCl2、AgNO3、HCl和MgSO4溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。其中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体或受热挥发出碱性气体的化合物,“-”表示观察不到明显变化。试回答下列问题。
|
|
A |
B |
C |
D |
E |
F |
|
A |
- |
- |
↓ |
↑ |
- |
- |
|
B |
- |
- |
↓ |
↓ |
↓ |
↓ |
|
C |
↓ |
↓ |
- |
↓ |
↓ |
↓ |
|
D |
↑ |
↓ |
↓ |
- |
↓ |
↑ |
|
E |
- |
↓ |
↓ |
↓ |
- |
- |
|
F |
- |
↓ |
↓ |
↑ |
- |
- |
(1)写出A~F物质的化学式。
A: ,B: ,C:
D: ,E: ,F:
(2)写出下列反应的离子方程式。
A与D反应:
B与F反应:
25. (14分)有机化合物D常用于香料工业和电镀工业。D的合成过程如图所示。
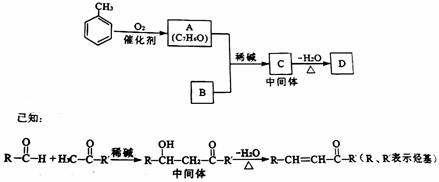
(1)①A中含氧官能团的名称是 。
②A可以发生的反应是 (填字母)。
a.还原反应 b.消去反应 c.水解反应 d.取代反应
(2)B是由碳、氢、氧三种元素组成的化合物,经质谱分析相对分子质量为58;分子中含有碳氧双键和2个甲基。B的结构简式是 。
(3)D的结构简式是 。
(4)已知B能和H2发生加成反应;E与C互为同分异构体。A氧化后的产物与B和H2加成后的产物在一定条件下反应制得E。该反应的化学方程式是 。
(5)F可作塑料的热稳定剂,由苯酚和B反应制得:
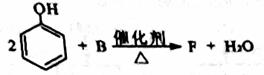
F能与 反应,F分子苯环上的一氯取代物只有两种,核磁共振氢谱显示其分子中含有4种不同类型的氢原子。F的结构简式是 。
反应,F分子苯环上的一氯取代物只有两种,核磁共振氢谱显示其分子中含有4种不同类型的氢原子。F的结构简式是 。
13.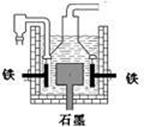 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)
=4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)
=4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH  Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
第II卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com