
题目列表(包括答案和解析)
32.(16分)
(1)已知4g甲烷气体充分燃烧生成CO 2(g)和H2O(l)时,放出Q kJ的热量。甲烷燃烧的热化学方程式为_____________________________________________。
(2)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中。反应方程式为H3PO4(aq)+KCl(aq) KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl‑含量变化情况如图所示。KDP晶体的一级品标准:Cl-质量分数低于0.2%。
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl‑含量变化情况如图所示。KDP晶体的一级品标准:Cl-质量分数低于0.2%。
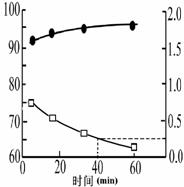


 由图中可知,当反应进行到约
min时,KDP晶体达到一级品标准,此时的产品产率约为
。
由图中可知,当反应进行到约
min时,KDP晶体达到一级品标准,此时的产品产率约为
。
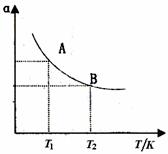
(3)如图在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,试回答:
①N2的转化率αA为 。
②在状态A时,平衡常数KA= (代入数值即可)当温度由T1变到T2时,KA KB(填“>”、“<”或“=”)
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比, c(Mg2+)一样大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,则溶液的pH=9
31.(16分)
某实验室对煤矸石的综合利用课题展开如下探究:
[资料检索]
①煤矸石主要含Al2O3、SiO2及Fe2O3。
②聚合氯化铝([Al2(OH)nCl6-n]m (1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
[探究思路]用煤矸石为原料,采用铝盐水解絮凝法,可制得聚合氯化铝。
[探究实验]
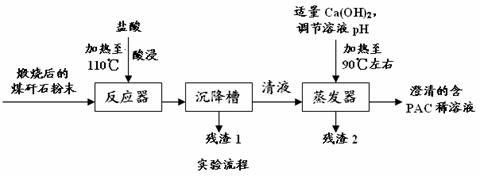
[交流讨论]
(1)用浓盐酸配20%的盐酸所需的玻璃仪器有:_____________________________。
(2)加20%的盐酸酸浸,有关的离子方程式为_____________________ 。
(3)残渣2的主要成分是 ,设计实验证明你的结论(填“操作”、“现象”): 。
(4)从澄清的PAC稀溶液获得聚合氯化铝固体,该实验操作是 ,得到PAC粗产品中可能含有杂质离子是 。
(5)从不引入杂质去考虑,调节溶液的pH可改为_________ (填序号)。
A.NaOH B.Al C.氨水 D.Al2O3
30.(16分)
某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
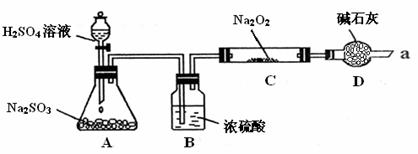
Ⅰ.装置B的作用 。
装置D的作用 。
Ⅱ.如何检验反应中是否有O2生成
。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3: 。
(1)假设2的反应方程式为 。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4。
该方案是否合理 (填“是”或“否”),理由是 。
(3)设计实验验证假设3:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,
,则假设3成立。
23.下列叙述正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl)
B.无色透明的酸性溶液中,Cu2+、K+、SO42-、NO3- 能大量共存
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.NaHCO3溶液中:c(H+) + c(H2CO3)=c(CO32-) + c(OH-)
22. 高铁电池的总反应为:
高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述错误的是
A.放电时每转移6mol电子,负极有2mol K2FeO4被还原
B.充电时阴极反应为:Zn(OH)2 + 2e- = Zn + 2OH-
C.放电时正极反应为:FeO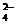 + 3e- + 4H2O = Fe(OH)3 + 5OH-
+ 3e- + 4H2O = Fe(OH)3 + 5OH-
D.充电时阳极附近溶液的碱性增强
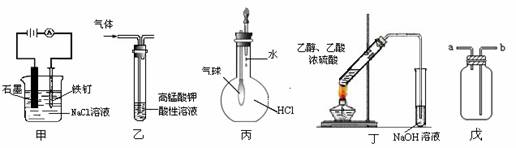
12.下列叙述正确的是
①装置甲可防止铁钉生锈 ②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性 ④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
A.①③⑤ B.③④ C.①②④ D.③⑤
11.下列离子方程式正确的是
A.石灰石溶于醋酸: CaCO3 + 2CH3COOH = 2CH3COO-+ Ca2+ + CO2↑+ H2O
B.钠与硫酸铜溶液反应: Cu2+ + 2Na = 2Na+ + Cu
C.铁屑溶于过量稀硝酸:3Fe + 8H+ + 2NO3-=3Fe2+ + 2NO↑+ 4H2O
 D.FeI2溶液中通入少量氯气:2Fe2+ +
Cl2= 2Fe3+ + 2Cl-
D.FeI2溶液中通入少量氯气:2Fe2+ +
Cl2= 2Fe3+ + 2Cl-
10.A、B、C、D、E 五种短周期元素,核电荷数依次增加。只有D为金属,A 与D 同主族,C与E同主族,B 原子最外层电子数是内层电子数的2 倍,D+与C3-具有相同的电子层结构。下列说法正确的是
A.C的氧化物都能跟碱反应
B.B的最高价氧化物的水化物是非电解质
C.C的氢化物与C的最高价氧化物的水化物能发生化合反应
D.沸点:CA3>EA3 离子半径:D+>C 3-
9.下列说法正确的是
A.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
B.淀粉和纤维素都可作为工业生产葡萄糖的原料
C.用水可区分乙酸乙酯和苯
D.钠跟乙醇反应比跟水反应剧烈
8.NA为阿伏加德罗常数,下列叙述正确的是 [M(Fe)=56]
A.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
B.22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
C.5.6 g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA
D.1mol过氧化氢分子中共用电子对数为3NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com