
题目列表(包括答案和解析)
3、冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是
A.熔融的MgO不导电 B.MgO分子间作用力很大
C.MgO熔点高 D.MgO属原子晶体
2.据2009年4月6日搜狐网站报道:国家质检总局称,在我国销售的德国NUK牌婴儿爽身粉含有一级致癌物“滑石粉”。已知滑石粉的化学式为Mg3(Si4O10)(OH)2,色白、滑爽、柔软、耐火。下列有关说法不正确的是 ( )
A.滑石粉属于无机硅酸盐类物质 B.滑石粉组成可表示为3MgO·4SiO2·H2O
C.爽身粉中添加滑石粉是利用它的滑爽、柔软、耐火性
D.滑石粉可能会与氢氟酸、NaOH溶液发生反应
1、下列选项中,可以用图表示物质或概念间的从属关系的是
|
|
X |
Y |
|
||
|
A |
纯净物 |
单质 |
化合物 |
||
|
B |
混合物 |
分散系 |
胶体 |
||
|
C |
元素周期表的纵列 |
主族 |
副族w.&w.^w.k.s.5*u.c.#o |
||
|
D |
有机物 |
烃 |
聚氯乙烯 |
12.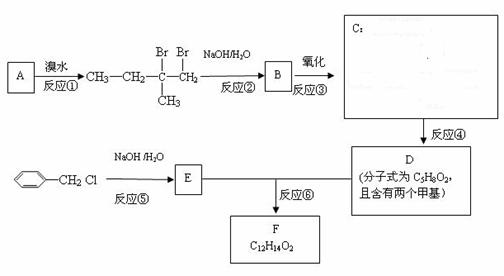 (16分)分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
(16分)分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
|
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现 种峰;
(2)C物质的官能团名称______;
(3)上述合成路线中属于取代反应的是 (填编号);
(4)写出反应④、⑥的化学方程式(不要求写出反应条件):
④ ,⑥ ;
(5)写出E属于芳香族化合物的所有同分异构体(不含E)的结构简式: 。
10.(16分)锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4 = ZnS↓+BaSO4↓。以下是工业生产流程。请回答有关问题:
Ⅰ.ZnSO4溶液的制备与提纯
有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等。
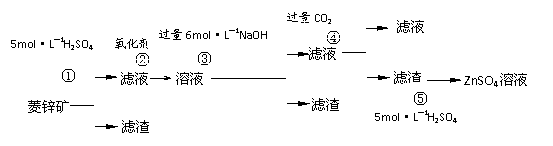
(1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
A.Cl2 B.H2O2 C.KMnO4 D.浓HNO3
(2)写出反应④的离子方程式: 。
(3)为了达到综合利用、节能减排的目的,上述流程中步骤 产生的 可以用于步
骤 (其中步骤选填①、②、③、④、⑤)。
Ⅱ.BaS溶液的制备
 有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = -1473.2 kJ•mol-1
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = -1473.2 kJ•mol-1
C(s)+ -O2(g)=CO(g); △H = -110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s); △H = -460 kJ•mol-1

(4)煅烧还原的热化学方程式为: 。
11(16分)、
(1)下列实验操作或叙述正确的是 (填写编号,多选扣分)
①不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体;
②为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴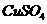 溶液;
溶液;
③用蒸馏水润湿的pH试纸测定溶液的pH一定有误差;
④向沸腾的NaOH稀溶液中滴加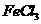 饱和溶液,可以制得
饱和溶液,可以制得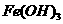 胶体;
胶体;
⑤配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑥定容时,俯视容量瓶刻度,造成所配溶液浓度偏高;
⑦称取5.85g 氯化钠固体,用100 mL蒸馏水溶解,得到1.00 mol·L-1 氯化钠溶液
(2)某钠盐溶液可能含有阴离子NO3-,CO32-,SO32-,SO42-,Cl-,Br-,I-。为鉴定这些离子,分别取少量溶液进行以下各步骤的实验:
步骤1测得混合液呈碱性;
步骤2滴加HCl时,溶液中出现气泡。该气体能使饱和石灰水溶液变浑浊;
 步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤4加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
步骤5加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
分析上述5个实验,回答下列问题。
①由实验步骤1判断可能存在的离子有 ;
②由实验步骤2判断可能存在的离子有几种可能性 ;分别是 ;
③由实验步骤3可得出的结论是 ;
④由实验步骤4和实验步骤5可确定肯定存在的离子有 ;
⑤由上述5个实验不能确定是否存在的离子是 。
9.(16分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知: SO2(g) +1/2O2(g)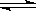 SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时
v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
 (3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
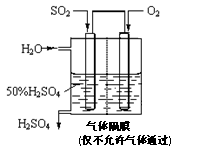
 (4)若以右图所示装置,用电化学原理生产硫酸,写
(4)若以右图所示装置,用电化学原理生产硫酸,写
出通入O2电极的电极反应式为 。
8、下图表示反应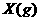

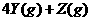 ,
,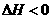 ,在某温度时
,在某温度时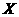 的浓度随时间变化的曲线:
的浓度随时间变化的曲线:
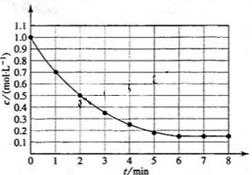 下列有关该反应的描述正确的是
下列有关该反应的描述正确的是
A.第6 后,反应就终止了
后,反应就终止了
B.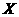 的平衡转化率为85%
的平衡转化率为85%
C.若升高温度,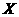 的平衡转化率将大于85%
的平衡转化率将大于85%
D.若降低温度,v正 > v逆
7.下表为短周期元素①~⑧的部分性质。
 元素编号 元素编号元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径/10-10m |
0.66 |
1.36 |
1.23 |
1.10 |
0.99 |
1.54 |
0.70 |
1.18 |
|
最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
最低化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法正确的是
A.元素④⑤形成的化合物是离子化合物
B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
C.元素①⑧形成的化合物具有两性
D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
6、向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系正确的是
A. Va<Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)
B. Va=Vb时:c (CH3COOH) +c (H+)>c (OH-)
 C. Va>Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+)
C. Va>Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+)
D. Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
5、下列有关实验操作的说法正确的是
A.加入盐酸以除去硫酸钠中的少许碳酸钠杂质
B.用洁净的玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
D.可用25.00ml碱式滴定管量取20.00ml 溴水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com