
题目列表(包括答案和解析)
5、设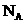 代表阿伏加德罗常数的数值,下列说法中正确的是:
代表阿伏加德罗常数的数值,下列说法中正确的是:
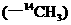 ①常温常压下,
①常温常压下,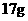 甲基所含的电子数为
甲基所含的电子数为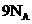
②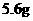
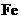 和足量的浓
和足量的浓 反应,转移电子为
反应,转移电子为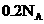
③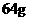 的铜发生氧化还原反应,不一定失去
的铜发生氧化还原反应,不一定失去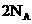 个电子
个电子
④常温常压下, 的乙酸溶液中,乙酸的分子数目一定小于
的乙酸溶液中,乙酸的分子数目一定小于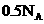 ⑤
⑤ 石墨或金刚石中六元环个数均为
石墨或金刚石中六元环个数均为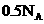
⑥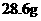
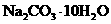 在晶体中或溶液中,含有的
在晶体中或溶液中,含有的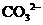 离子均小于
离子均小于 ⑦
⑦ 与水反应可生成
与水反应可生成 和
和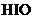 ,则
,则
 参加反应转移电子为
参加反应转移电子为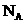
⑧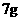 聚乙烯中含有
聚乙烯中含有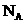 个
个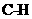 键( )
键( )
A.①④⑧ B.①②④ C.①③⑧ D.①⑤⑦
4、中科大陈乾旺教授等人发明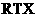 合成金刚石的新方法,化学原理为:
合成金刚石的新方法,化学原理为:
① (未配平)
(未配平)
该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:
②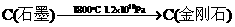 。
。
以下表述正确的是( )
A.反应①中既有旧化学键的断裂又有新化学键的形成
B.新方法利用的是化学变化,旧方法利用的是物理变化
C.在反应①中每生成 金刚石需要消耗
金刚石需要消耗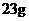 金属钠
金属钠
D.反应①和反应②中所得的金刚石都是还原产物
3、在浓盐酸中,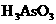 与
与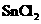 反应的离子方程式为:
反应的离子方程式为: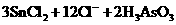
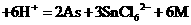 。
。
关于该反应说法的正确组合是:①氧化剂是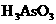 ;②还原性:
;②还原性: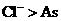 ;
;
③每生成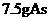 ,还原剂失去的电子为
,还原剂失去的电子为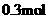 ;④
;④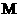 为
为 ;⑤
;⑤ 是氧化产物。( )
是氧化产物。( )
A.①③ B.①③⑤ C.①②③④ D.①②④⑤
2、从下列事实所得出的相应结论正确的是( )
|
|
实验事实 |
结论 |
|
① |
 的水溶液可以导电 的水溶液可以导电 |
 是电解质 是电解质 |
|
② |
将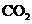 通入到 通入到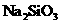 溶液中产生白色浑浊 溶液中产生白色浑浊 |
酸性: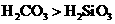 |
|
③ |
 溶液与 溶液与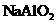 溶液混合产生白色沉淀 溶液混合产生白色沉淀 |
酸性: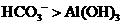 |
|
④ |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性: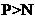 |
|
⑤ |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有 NH4+ |
A.③④⑤ B.②③⑤
C.①②③ D.全部
1、2008年诺贝尔化学获奖得者之一钱永健在发现研究绿色莹光蛋白(GFP)如何发光等作出了突出贡献。下列对GFP等的叙述合理的是( )
A.GFP在硫酸铜或饱和硫酸铵溶液中发生盐析,盐析是可逆过程
B.GFP在酸、碱、酶作用下发生水解,水解的最终产物氨基酸只能与碱反应
C.GFP在乙醇等作用下会凝结、变性,变性为不可逆过程
D.GFP与水的液态混合物可用盐析法分离,盐析法为化学方法
37.(10分 ) Ⅰ已知在酸性条件下有以下反应关系:
① KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
② Br2能将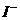 氧化为I2;
氧化为I2;
③ KIO3能将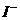 氧化为I2,也能将
氧化为I2,也能将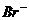 氧化为Br2,其本身被还原为I2。
氧化为Br2,其本身被还原为I2。
(1)现向含有1mol KI的硫酸溶液中加入含a mol KBrO3的溶液,a的取值不同,所得产物也不同。试将讨论的结果填入表
|
编号 |
a的取值范围 |
产生的化学式(或离子符号) |
|
① |
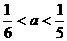 |
|
|
② |
w.&w.^w.k.s.5*u.c.#o |
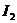 、 、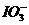 、 、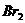 |
(2)若产物中碘单质和碘酸钾的物质的量相等,a的值为 。
Ⅱ铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的流程如下:
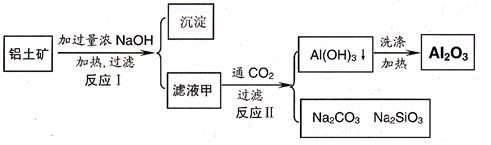
(1)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是 (填字母序号)
a.AlO2-或Al(OH)4- b.OH- C.SiO32-
(2)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀部分消失。
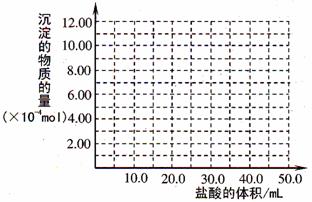
(3)取(2)电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。请画出生成沉淀的物质的量与加入盐酸体积的关系图。
35、(12分 ) Ⅰ 有一些常见化学反应可用下式表示A+B→C+D+H2O
请你根据下面的提示回答下列问题:
(1)若A、C均含有铝元素,且C溶液呈酸性,则A可能是 。
写出一个符合该反应的化学方程式: 。
(2)若C为不溶于稀硝酸的白色沉淀,则该反应的化学方程式可为
。
Ⅱ
某可溶性离子化合物的化学式为: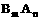 。
。
(1)写出溶于水中的电离方程式 ;
(2)常温下 ,若测得该盐溶液的pH=11,水解离子方程式为
Ⅲ.烷烃分子中的基团可能有四种:a个--CH3,b个--CH2-,c个-CH-,
| |
d个-C-,除CH4外,请作以下讨论:
|
(1) 下列说法中正确的是 ;
A.d增加1,a就会增加2
B. c增加1,a就会增加3 C.a与b数值变化无关 D. b增加1,a就会增加2
(2) 若某烷烃分子中,b=2 c=d=1,满足此条件的分子结构,共 种
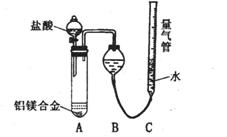
34. (6分 )铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
[探究一]实验方案:铝镁合金 测定剩余固体质量
测定剩余固体质量
实验步骤:(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥
 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”或“偏低”“无影响”)。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”或“偏低”“无影响”)。
[探究二] 实验方案:铝镁合金 测定生成气体的体积实验装置: 问题讨论:
测定生成气体的体积实验装置: 问题讨论:
(3)某同学提出该实验装置不够完善,应在A、B之间
添加一个干燥、除酸雾的装置。你的意见是: (填“需要”或“不需要”)。
(4) 为使测定结果尽可能精确,实验中除需注意准确称量固体质量、检查装置的气密性、冷却并左右液面相平后度数、视线平视、还应注意的问题是
:① ② (可不写满)
 [探究三]实验方案:称量x
g铝镁合金粉末.放在如右图所示装置的惰性电热板上,通电使其充分灼烧。 问题讨论:
[探究三]实验方案:称量x
g铝镁合金粉末.放在如右图所示装置的惰性电热板上,通电使其充分灼烧。 问题讨论:
(5) 欲计算Mg的质量分数,该实验中还需测定的数据是
(6) 若用空气代替O2进行实验,对测定结果何影响?
(填“偏高”或“偏低”或“无影响”)。
33、(10分 )化学兴趣小组对用铜制取硫酸铜晶体的实验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,在溶液中置一些铂丝,溶液慢慢变蓝色,反应速率明显加快。此时,其他组的同学提出方案如下:
|
|

 乙组:Cu
CuO
CuSO4
乙组:Cu
CuO
CuSO4
|
 丙组:Cu
CuSO4
丙组:Cu
CuSO4
|
|
|


 丁组:Cu
Cu(NO3)2
Cu(OH)2
CuSO4
丁组:Cu
Cu(NO3)2
Cu(OH)2
CuSO4
|
 戊组:Cu
CuSO4
戊组:Cu
CuSO4
(1)甲组实验可用一个化学反应方程式表示为 ,
(2)在五个方案中,科学性有错的是 组方案,经济性最差的是 组方案。
(3)可持续发展的原则要求化工生产①能耗尽量低,这应排除使用 组方案;②无污染,这应排除 组方案。
(4)相对能耗低,污染小的是 组方案。该给从反应器中排出的溶液中
(含有少量H2SO4以抑制水解)取得产品的实验操作步骤应为w.&w.^w.k.s.5*u.c.#o 、 、 ,对取得产品后残留物质的处理方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com